题目内容
(2005?上海)为了除去氯化钠样品中的碳酸钠杂质,兴趣小组最初设计了如下的方案并进行实验.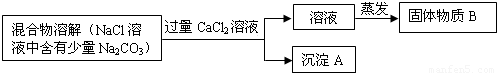
(1)写出沉淀A的化学式.
(2)加入CaCl2溶液后,分离除去沉淀A的实验操作方法是.
(3)同学在实验过程中,又发现了新的问题:此方案很容易引入新的杂质,请写出固体物质B的成分(用化学式表示).
(4)同学继续探究后又提出新的方案:将混合物溶解,若滴加盐酸至不再产生气体为止,则既能除去Na2CO3杂质,又能有效地防止新杂质的引入.写出有关反应的化学方程式:.
【答案】分析:(1)分析所发生的反应,判断生成物中沉淀的化学式;
(2)根据混合物特点,确定合理的分离操作;
(3)分析除杂过程,判断所得固体的组成,用化学式表示;
(4)分析发生的反应,写出反应的化学方程式.
解答:解:(1)加入氯化钙与混合溶液中的碳酸钠反应,生成碳酸钙沉淀;
故选CaCO3;
(2)加入氯化钙后所得混合物为不溶性的碳酸钙和氯化钠、氯化钙的混合溶液,应进行过滤分离混合物;
故答案为:过滤;
(3)由于加入过量的氯化钙,所以滤液为氯化钠和氯化钙的混合溶液,蒸发后得到固体为氯化钠和氯化钙;
故答案为:NaCl、CaCl2;
(4)向氯化钠、碳酸钠的混合溶液中滴加稀盐酸,盐酸与碳酸钠反应,生成氯化钠、水和二氧化碳;
故答案为:Na2CO3+2HCl═2NaCl+H2O+CO2↑.
点评:向混合溶液中滴加稀盐酸,可观察到有气泡放出,易于控制所加盐酸的量,即使稍过量,盐酸易挥发,蒸发时会随水一起蒸发掉,不会引入新的杂质可以得到纯净的物质.
(2)根据混合物特点,确定合理的分离操作;
(3)分析除杂过程,判断所得固体的组成,用化学式表示;
(4)分析发生的反应,写出反应的化学方程式.
解答:解:(1)加入氯化钙与混合溶液中的碳酸钠反应,生成碳酸钙沉淀;
故选CaCO3;
(2)加入氯化钙后所得混合物为不溶性的碳酸钙和氯化钠、氯化钙的混合溶液,应进行过滤分离混合物;
故答案为:过滤;
(3)由于加入过量的氯化钙,所以滤液为氯化钠和氯化钙的混合溶液,蒸发后得到固体为氯化钠和氯化钙;
故答案为:NaCl、CaCl2;
(4)向氯化钠、碳酸钠的混合溶液中滴加稀盐酸,盐酸与碳酸钠反应,生成氯化钠、水和二氧化碳;
故答案为:Na2CO3+2HCl═2NaCl+H2O+CO2↑.
点评:向混合溶液中滴加稀盐酸,可观察到有气泡放出,易于控制所加盐酸的量,即使稍过量,盐酸易挥发,蒸发时会随水一起蒸发掉,不会引入新的杂质可以得到纯净的物质.

练习册系列答案
相关题目
(2005?上海)被称为“生命之源”的水(H2O)和被称为“绿色氧化剂”的双氧水(H2O2),都是由氢、氧两种元素组成的化合物,通常情况下均为无色液体.在化学实验开放日,实验小组的同学用下面的方法鉴别水和双氧水两瓶无色液体,请填写有关内容:
(1)B试管中发生反应的化学方程式:______ 2H2O+O2↑
| 实验步骤 | 实验现象 | 实验结论 |
| ①将等体积的两种无色液体分别加入A、B两个试管中. ②分别向A、B两试管中同时加入等质量(少量)的二氧化锰,观察现象.  | A试管中无明显现象 B试管中有气泡产生 | A试管中的无色液体是: ______; B试管中的无色液体是: ______; |
(2005?上海)为了研究从长期使用的热水瓶中倒出的片状固体(水垢)的成分,学生进行以下探究:
根据上述探究,估计此水垢的成分中含有______(写物质名称).
写出实验①中发生反应的化学方程式:______ CaO+CO2↑
| 操 作 | 现 象 | 结 论 | |
| 实 验 ① | 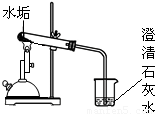 | 水垢变白、变疏松 | (此处不填) |
| 澄清石灰水变浑浊 | 水垢分解产物中有______(写化学式) | ||
| 实 验 ② | 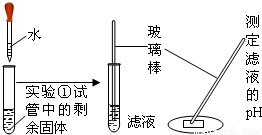 | 固体部分溶解,测得PH约为12 | 该滤液呈______性 |
写出实验①中发生反应的化学方程式:______ CaO+CO2↑
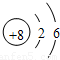 B、
B、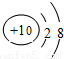 C、
C、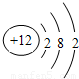 D、
D、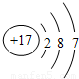
 的气体比较活泼,能与某些金属发生反应,这种气体可能是( )
的气体比较活泼,能与某些金属发生反应,这种气体可能是( )