题目内容
【题目】物质种类繁多,性质各异,我们要学会用网络图找到物质间的关系。图一、图二中“→”表示转化关系。
(1)根据图一完成下列问题。
图中x的化学式是_____;y由两种元素组成,化学式是_____;
图中①反应的化学方程式是_____;
(2)根据图二,请写出符合图示转化关系的一组物质_____。(依次写出A、B、C的化学式)

【答案】H2SO4 ZnO H2SO4+Zn(OH)2=ZnSO4+2H2O CO2、Na2CO3、CaCO3
【解析】
(1)氢氧化锌、碳酸锌和氧化锌能与x反应生成硫酸锌,故x是硫酸,①是硫酸与氢氧化锌反应生成硫酸锌和水,③是氧化锌与硫酸反应生成硫酸锌和水;
(2)A能生成B,B能生成C,C能生成A,二氧化碳能生成碳酸钠、碳酸钠能生成碳酸钙以及碳酸钙能生成二氧化碳,化学式分别是:CO2、Na2CO3、CaCO3。

 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案【题目】KNO3和NaCl在不同温度时的溶解度如表所示,请回答下列问题:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | |
溶解度/g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | 38.4 | |
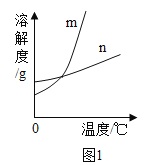
(1)依据上表数据,绘制出KNO3和NaCl的溶解度曲线,图1中能表示NaCl溶解度曲线的是_______(填m或n)。
(2)如图2所示,20℃时,将盛有饱和KNO3溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出,加入的物质可能是下列中_____(填字母序号)。

A.氢氧化钠固体 B.生石灰固体 C.水 D.硝酸铵固体
(3)“配制40g质量分数为5%的氯化钠溶液”时,实验的部分操作如图3所示。
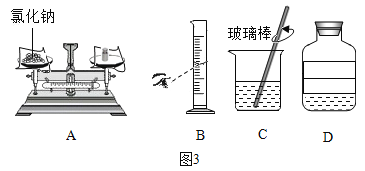
①称量时A出现了右盘低的现象,接下来的操作应该是_____(填序号)。
A 左边的平衡螺丝向左侧 B 右边的平衡螺丝向右调
C 右盘中减少砝码 D 左盘中增加食盐
②量取水时,如果按照图B的方法读数,会使配制的溶液溶质质量分数_____(填“偏大”或“偏小”)。
③若配制过程中,在已经有少量水的烧杯中加入氯化钠和水,其他操作均规范,则所得溶液中氯化钠的质量分数_____(填“>”或“<”或“=”)5%。
(4)图4是实验室制取某气体的部分装置图。请根据要求回答问题:
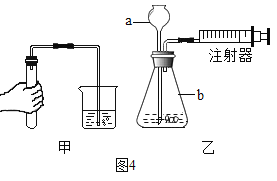
①小明用甲图方法检查装置的气密性,但没有看到气泡,其原因可能是下列选项中的_____。
a.先用手捂住试管一段时间,后将导管一端放入水中;
b.先将导管一端放入水中,后用手捂住试管一段时间。
②接着,用乙图方法检查装置的气密性,先将注射器活塞缓慢向右拉,看到仪器a下端有气泡逸出;再将注射器活塞向左推,看到仪器a下方__________________(填现象),说明装置气密性良好;实验室用该装置制取氧气时,可将仪器a换成注射器,其优点是___________________________。
【题目】小明同学欲通过实验证明“二氧化锰是氯酸钾受热分解的催化剂”这一命题,
(设计与实验)请你帮小明同学填写表中未填完的空格:
实验操作 | 实验现象 | 实验结论或总结 | ||
各步骤结论 | 总结 | |||
实验一 | 将氯酸钾加热至融化,伸入带火星的木条. | 木条复燃 | 氯酸钾受热要分解产生氧气,但是①_____. 反应的文字表达式为:②_____. | 二氧化锰是氯酸钾受热分解的催化剂 |
实验二 | 加热二氧化锰,伸入带火星的木条. | 木条不复燃 | 二氧化锰受热不产生氧气. | |
实验三 | ③_____ | 木条迅速复 燃 | 二氧化锰能加快氯酸钾的分解 | |
(交流与讨论)
(1)在小明的实验探究中,实验一和实验二的作用是_____.
(2)小英同学认为仅由上述实验还不能完全得出表内“总结”,她补充设计了两个探究实验,最终通过实验,最终完成了对“命题”的实验证明:
第一方面的实验操作中包含了两次称量,其目的是:_____;
第二方面的实验是要_____.
【题目】向盛有20g10%氢氧化钠溶液的烧杯中逐滴滴入7.3%的稀盐酸,下列是关于溶液总质量或溶液pH随盐酸质量变化的关系图(Q点表示恰好完全反应)。其中正确的是
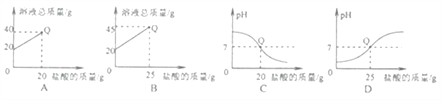
A. A B. B C. C D. D
【题目】取50g碳酸钠和氯化钠的混合溶液。向其中逐滴加入稀盐酸。加入稀盐酸的质量和生成气体的质量见下表(气体的溶解度忽略不计)。
第一组 | 第二组 | 第三组 | |
稀盐酸的质量/g | 20 | 40 | 60 |
生成气体的质量/g | 2.0 | m | 5.5 |
另取该混合溶液50g加入上述浓度的稀盐酸至恰好完全反应,此时溶液的pH=7,然后再加入足量的硝酸银溶液得到白色沉淀57.4g。试分析计算:
(1)50g混合溶液中碳酸钠的质量为_____g。
(2)50g混合溶液中氯化钠的质量分数是多少?_____(写出计算过程,计算结果精确至0.1%)
【题目】为测定CuCl2和FeCl2组成的混合溶液中FeCl2的质量分数,进行如下实验:
①取200g混合溶液加入足量的AgNO3溶液,经过滤、洗涤、干燥、称量,得到143.5gAgCl固体;②另取原混合溶液各200g与含有杂质的废铁屑反应(杂质不溶于水,也不参与反应),共做了五组实验,其实验数据如下表。
实验组别 | 一 | 二 | 三 | 四 | 五 |
混合溶液质量/g | 200 | 200 | 200 | 200 | 200 |
铁屑质量/g | 6 | 9 | 12 | 15 | 18 |
析出铜的质量/g | 6.4 | 9.6 | m | 16 | 16 |
请分析计算:
(1)表中第三组实验的m值为_______。
(2)第_____组实验恰好完全反应。
(3)铁屑中铁的质量分数为多少___________?(计算结果精确到0.1%)
(4)原混合溶液中FeCl2的质量分数为多少______________?(计算结果精确到0.1%)