题目内容
【题目】取50g碳酸钠和氯化钠的混合溶液。向其中逐滴加入稀盐酸。加入稀盐酸的质量和生成气体的质量见下表(气体的溶解度忽略不计)。
第一组 | 第二组 | 第三组 | |
稀盐酸的质量/g | 20 | 40 | 60 |
生成气体的质量/g | 2.0 | m | 5.5 |
另取该混合溶液50g加入上述浓度的稀盐酸至恰好完全反应,此时溶液的pH=7,然后再加入足量的硝酸银溶液得到白色沉淀57.4g。试分析计算:
(1)50g混合溶液中碳酸钠的质量为_____g。
(2)50g混合溶液中氯化钠的质量分数是多少?_____(写出计算过程,计算结果精确至0.1%)
【答案】13.25g 17.54%
【解析】
(1)20克稀盐酸完全反应生成二氧化碳的质量为2.0g,所以40g盐酸完全反应生成二氧化碳质量为4.0g;在第三组实验中加入60克盐酸只生成5.5克二氧化碳,说明第三组实验中盐酸有剩余,碳酸钠反应完,完全反应生成气体的质量为5.5克,设生成5.5g二氧化碳,需要参加反应的碳酸钠的质量为x,生成氯化钠的质量为y,则:
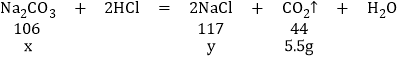
![]()
x=13.25g,y=14.63g,
(2)设氯化钠与硝酸银反应,生成57.4g沉淀需要氯化钠的质量为z则:

![]()
z=23.4g,
所以原混合液中氯化钠的质量为:23.4g﹣14.63g=8.77g,混合液中氯化钠的质量分数是:![]() ×100%=17.54%
×100%=17.54%
答案:
(1)混合液中碳酸钠的质量是13.25g;
(2)混合液中氯化钠的质量分数是17.54%

 全能测控一本好卷系列答案
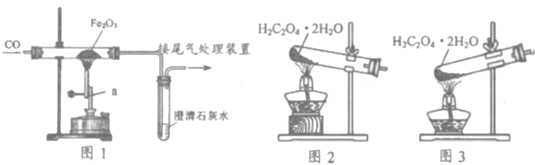
全能测控一本好卷系列答案【题目】碳酸氢钠是化学实验中常见的药品,在工业上有很多制取方法。重庆一中兴趣小组的同学 们查询资料发现了一种“气相固碳法”:向氢氧化钠溶液中通入过量的CO2气体。
整理资料:Ⅰ、过量CO2通入NaOH溶液,发生两步反应:
①_________________________________(写出化学方程式);
②Na2CO3 +H2O + CO2=2NaHCO3
Ⅱ、碳酸钠和碳酸氢钠的溶解度表(部分)
温度/℃ | 0 | 15 | 20 | 30 |
Na2CO3 溶解度/g | 7.1 | 13.25 | 21.8 | 39.7 |
NaHCO3 溶解度/g | 6.9 | 8.72 | 9.6 | 11.1 |
15℃时,将10g氢氧化钠固体完全溶解溶于100g水中(如图1),而后匀速的通入二氧化碳气体,同时用pH计测定溶液的pH值变化(如图2)。

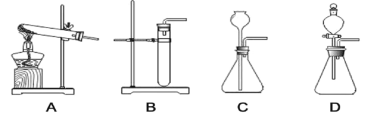
(1)图 1 所示实验中,产生 CO2 的装置应该选择:_____(填序号);
(2)为了确定M处溶液的溶质成分,取少量样品于试管中,进行如下实验:
步骤 | 加入试剂 | 实验现象 | 实验结论 |
① | 加入_______溶液 | 溶液变红 | NaOH和Na2CO3 |
② | 加入过量_______溶液 | ______ |
(3)实验中,t2后溶液的pH基本不变,则此时烧杯中观察到的现象是_____。