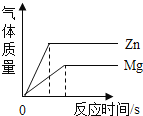
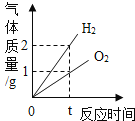
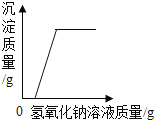
题目内容
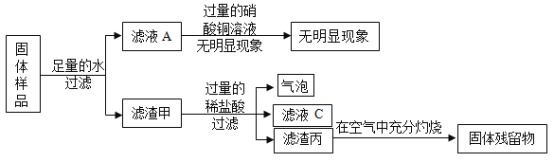
【题目】有一包白色粉末,可能含有Na2CO3、Na2SO4、K2SO4、KCl、Ba(OH)2中的一种或几种,为了探究其成分,实验过程如图所示:
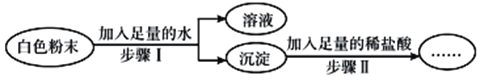
关于该实验的说法中,正确的是( )
①步骤Ⅱ中沉淀全部溶解,则原白色粉末一定有Ba(OH)2、Na2CO3,可能有KCl
②步骤Ⅱ中沉淀不溶解,则原白色粉末一定没有Na2CO3
③步骤Ⅱ中沉淀部分溶解,则原白色粉末一定有Ba(OH)2、Na2CO3、K2SO4
④步骤Ⅱ中沉淀部分溶解,则原白色粉末的组成可能有3种情况.
A. ①②B. ①②③C. ②③D. ③④
【答案】A
【解析】
碳酸钠和氢氧化钡会生成溶于酸的碳酸钡沉淀,硫酸钠、硫酸钾会与氢氧化钡反应生成不溶于酸的硫酸钡沉淀,所以:
步骤Ⅱ中沉淀全部溶解,则原白色粉末一定有氢氧化钡、碳酸钠,题中的现象不能确定是否含有氯化钾,故①正确;
②步骤Ⅱ中沉淀不溶解,则原白色粉末一定有氢氧化钡,一定没有碳酸钠,故正确;
③步骤Ⅱ中沉淀部分溶解,则原白色粉末一定有氢氧化钡、碳酸钠,可能含有硫酸钠、硫酸钾中的一种或两种,故错误;
④步骤Ⅱ中沉淀部分溶解,则原白色粉末的组成可能有氢氧化钡、碳酸钠、硫酸钠,氢氧化钡、碳酸钠、硫酸钾,氢氧化钡、碳酸钠、硫酸钾、硫酸钠,氢氧化钡、碳酸钠、硫酸钠、氯化钾,氢氧化钡、碳酸钠、硫酸钾、氯化钾,氢氧化钾、碳酸钠、硫酸钾、硫酸钠、氯化钾6种情况,故错误。
故选:A。

 学业测评一课一测系列答案
学业测评一课一测系列答案【题目】小维与家人聚餐时,对火锅燃料“固体酒精”产生了好奇,于是他与同学对其成分进行如下探究。
(查阅资料)(1)该固体酒精是用酒精、氯化钙和氢氧化钠按一定的质量比混合制成的。
(2)氯化钙、氯化钡溶液均呈中性。
(提出问题)(1)酒精中是否含有碳元素? (2)固体酒精中氢氧化钠是否变质?
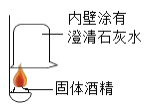
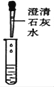
(实验探究)(1)如图所示进行实验,发现澄清石灰水_____,可得出酒精中含有碳元素的结论。
(2)取少量固体酒精于烧杯中,加足量的水充分溶解后静置,发现烧杯底部有白色沉淀,请用化学方程式表示该沉淀是如何形成的:_____,由此说明氢氧化钠已变质。
(实验结论)(1)酒精中含有碳元素。 (2)固体酒精中氢氧化钠己经变质。
(拓展延伸)为进一步确定氢氧化钠的变质程度,分组进行探究。甲组同学取烧杯上层清液于两支试管中,按如图所示进行实验。
实验方案 |
|
|
实验现象 | 溶液_____ | 产生白色沉淀 |
实验结论 | 清液中有氢氧化钠 | 清液中有____ |
乙组同学认为甲组实验不能证明清液中一定有氢氧化钠,理由是_____。他们另取烧杯中的上层清液,加足量氯化钡溶液,充分反应后,静置,取上层清液,滴加酚酞溶液,酚酞溶液变红,证明清液中一定有氢氧化钠。
(反思交流)乙组实验中加足量氯化钡溶液的目的是_____。
(实验结论)小组同学经过讨论,一致认为该固体酒精中的氢氧化钠部分变质。
【题目】碳酸氢钠是化学实验中常见的药品,在工业上有很多制取方法。重庆一中兴趣小组的同学 们查询资料发现了一种“气相固碳法”:向氢氧化钠溶液中通入过量的CO2气体。
整理资料:Ⅰ、过量CO2通入NaOH溶液,发生两步反应:
①_________________________________(写出化学方程式);
②Na2CO3 +H2O + CO2=2NaHCO3
Ⅱ、碳酸钠和碳酸氢钠的溶解度表(部分)
温度/℃ | 0 | 15 | 20 | 30 |
Na2CO3 溶解度/g | 7.1 | 13.25 | 21.8 | 39.7 |
NaHCO3 溶解度/g | 6.9 | 8.72 | 9.6 | 11.1 |
15℃时,将10g氢氧化钠固体完全溶解溶于100g水中(如图1),而后匀速的通入二氧化碳气体,同时用pH计测定溶液的pH值变化(如图2)。

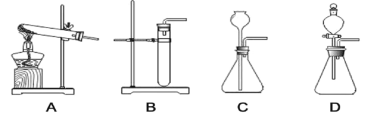
(1)图 1 所示实验中,产生 CO2 的装置应该选择:_____(填序号);
(2)为了确定M处溶液的溶质成分,取少量样品于试管中,进行如下实验:
步骤 | 加入试剂 | 实验现象 | 实验结论 |
① | 加入_______溶液 | 溶液变红 | NaOH和Na2CO3 |
② | 加入过量_______溶液 | ______ |
(3)实验中,t2后溶液的pH基本不变,则此时烧杯中观察到的现象是_____。