题目内容
【题目】某小组同学在实验室研究铝与氯化铜溶液的反应。
实验操作 | 实验现象 |
| ①红色物质附着于铝片表面 ②铝片表面逸出大量无色气体,放出大量的热 ③烧杯底部出现红色沉淀和白色沉淀 |
(1)打磨铝片的目的是_______。
(2)现象①和现象③中的红色物质均为Cu,生成该物质的化学方程式为_______。
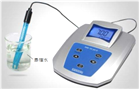
(3)经检验,现象②中的无色气体为氢气。甲同学猜测可能是氯化铜溶液显酸性,经pH计检验,pH_______7,证实了甲的猜想。
(4)探究白色沉淀的化学成分。
乙同学通过查阅资料认为白色沉淀可能是氯化亚铜(CuCl)。
CuCl中铜元素的化合价是_______。
【查阅资料】
①CuCl可与浓氨水反应生成无色的Cu(NH3)2+和Cl-。
②Cu(NH3)2+在空气中易被氧化变为蓝色;Cl-可与硝酸银溶液反应,产生白色沉淀。
【进行实验】
①取烧杯底部的白色沉淀,充分洗涤;
②向其中加入浓氨水,沉淀溶解得到无色溶液,将无色溶液分为两份;
③取其中一份无色溶液……
④将另一份无色溶液放置于空气中……
以上步骤③的实验方案是_______;步骤④的现象是_______。
【得出结论】通过实验可以确定,该白色固体是CuCl。
【反思与评价】Al和CuCl2溶液反应为什么会出现CuCl呢?
丙同学猜测:可能是Cu与CuCl2溶液反应生成了CuCl。
丙同学为了验证猜想,取Cu粉与15% CuCl2溶液混合,无白色沉淀产生。
(5)丙通过分析Al与CuCl2溶液反应的实验现象,改进了实验,证明了Cu与CuCl2溶液反应生成了CuCl,改进方法是________。
【答案】 除去表面氧化铝 2Al+ 3CuCl2 =3 Cu +2 AlCl3 < +1 向其中滴加硝酸银溶液 变为蓝色 将Cu与CuCl2溶液混合并加热
【解析】(1)铝片表面有致密的氧化膜,打磨铝片的目的是除去表面氧化铝;
(2)Al的活泼性比Cu强,可以置换出CuCl2溶液中的Cu,发生反应的化学方程式为2Al+ 3CuCl2 =3 Cu +2 AlCl3;
(3)常温下,酸性溶液的pH<7;
(4)CuCl中氯元素的化合价为-1价,则CuCl中铜元素的化合价是+1;
被氧化变为蓝色;Cl-可与硝酸银溶液反应,产生白色沉淀。
【进行实验】
步骤③的实验方案是向其中滴加硝酸银溶液,检验溶液中有Cl-;步骤④的现象是,一段时间后变为蓝色,说明溶液中含有Cu(NH3)2+;
(5)铝和氯化铜溶液反应过程中有白色沉淀生成,反应过程放出大量热量,现证明Cu与CuCl2溶液反应生成CuCl,可以加热观察是否生成白色沉淀,若加热出现沉淀说明Cu与CuCl2溶液反应生成了CuCl,若不出现沉淀说明Cu与CuCl2溶液不能反应生成了CuCl。

 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案【题目】合理利用资源和保护环境是我们关注的问题。请回答:
(1)化石燃料是一类重要能源,它包括煤、石油和__________。
(2)煤作为燃料给我么们带来了益处,但对环境也造成了不良影响。
①下列关于酸雨的叙述正确的是__________(填序号)
A. 腐蚀大理石雕像 B. 是由二氧化碳和二氧化硫引起的
C. 酸化土壤 D. 对海洋生物没有影响
②使燃料充分燃烧,通常除了考虑燃烧时要有足够的空气,还要考虑___________;
(3)为减少污染,城市公共交通正大力推广使用压缩天然气或液化石油气为动力。某种清洁燃料的主要成份是A,一定质量的A物质在B物质中充分燃烧,如下表所示)。
物 质 | A | B | C | D |
|
分子示意图 | ? |
|
|
| |
反应前质量/g | 44 | ? | 0 | 0 | |
反应后质量/g | 0 | 0 | 132 | 72 |
①在上述反应中提供氧、具有氧化性的物质为______________。(写化学式)
②A物质中各元素的质量比为________________。