题目内容
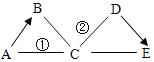
【题目】现有一包白色粉末,可能是由氯化钠、氢氧化钠、硝酸钠和硫酸铜中的一种或多种物质组成。为确定其成分进行了如下实验:(已知Ag2SO4微溶于水,常温下AgOH极不稳定,易分解为棕褐色难溶于水的氧化银固体)
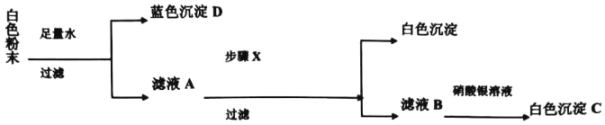
①通过以上实验,不能确定白色粉末中是否含有的成分是_____。
②生成蓝色沉淀D的化学方程式是_____,生成白色沉淀C的化学方程式是_____,滤液A中一定含有的溶质是_____。
③步骤X是_____。
【答案】NaNO3 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 NaCl+AgNO3=AgCl↓+NaNO3 Na2SO4、NaCl 加入足量的Ba(NO3)2溶液
【解析】
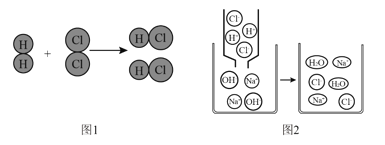
硫酸铜和氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,Ag2SO4微溶于水,常温下AgOH极不稳定,易分解为棕褐色难溶于水的氧化银固体,氯离子和银离子反应会生成氯化银沉淀,
白色粉末中加入足量的水后会生成蓝色沉淀D,所以样品中一定含有氢氧化钠、硫酸铜,滤液B中加入硝酸银,生成白色沉淀C,所以B中一定含有氯离子,样品中一定含有氯化钠,所以加入的X是为了除去A中的硫酸根离子,所以X是硝酸钡,
(1)通过以上实验不能确定白色粉末中是否含有的成分是硝酸钠;
(2)生成蓝色沉淀D的反应是氢氧化钠和硫酸铜反应生成氢氧化铜沉淀和硫酸钠,化学方程式是:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4,生成白色沉淀C的反应是氯化钠和硝酸银反应生成氯化银沉淀和硝酸钠,化学方程式是:NaCl+AgNO3=AgCl↓+NaNO3,滤液A中一定含有的溶质是硫酸钠、氯化钠;
(3)步骤X是加入足量的硝酸钡。

【题目】某兴趣小组的同学从家里找来矿泉水瓶进行探究活动,请你参与:
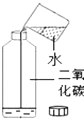
(提出问题)CO2能与水反应吗?
(实验)甲同学按如图所示的实验,打开瓶塞,迅速将烧杯中的水倒入瓶中并拧紧瓶塞,振荡,一会后发现__________________得出结论:CO2能与水反应.
(反思)乙认为甲的实验不足以证明CO2能与水反应.乙的理由是:__.
(补充实验)取少量甲实验软塑料瓶中的液体于试管中,向其中滴加紫色石蕊试液,溶液变红,乙同学认为这可以说明CO2能与水反应(提示:石蕊是一种遇酸变红的紫色液体).
你认为乙同学验证CO2能与水反应的方法,是通过证明_________(填序号).
A 反应物被消耗 B 有新物质生成
(反思)丙同学认为乙同学的实验也不足以证明CO2能与水反应.
(再实验)该兴趣小组的同学经过思考、讨论,设计了如下实验方案,探究CO2能与水反应.请你完成如下实验报告.
实验操作 | 实验现象 | 结论 |
(1)向干燥的紫色小花上喷水 | 小花仍为紫色 | ______ |
(2)把干燥的紫色小花放入盛有二氧化碳的集气瓶中 | 小花仍为紫色 | ______ |
(3)把实验(1)后的小花放入盛有二氧化碳的集气瓶中 | 小花由紫色变红色 | ______ |
(结论)CO2能与水反应;其化学反应方程式为__________.