题目内容
【题目】氯化铬晶体(CrCl3·6H2O)是一种重要的工业原料,工业上常用铬酸钠(Na2CrO4)来制备。实验室中则以红矾钠(Na2Cr2O7)为原料制备CrCl3·6H2O,工艺流程如下:
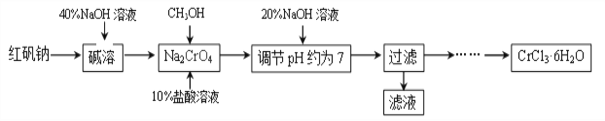
已知:a.CH3OH+10HCl+2Na2CrO4 2CrCl3+4NaCl+CO2 ![]() +7H2O;
+7H2O;
b.Cr(OH)3是一种难溶于水的碱;
c.CrCl3·6H2O不溶于乙醚,易溶于水、乙醇。
(1)在“调节pH约为7”的步骤中,测定溶液的pH可使用____________。请写出该步骤的反应原理_____________(用化学反应方程式表示)。
(2)“碱溶”步骤中所加40%NaOH溶液不宜过量太多的原因是_________________。
(3)请你补充完整由过滤后得到的固体Cr(OH)3制备CrCl3·6H2O的实验方案:将过滤后所得固体溶解于盐酸,通过蒸发浓缩、________、过滤、洗涤、低温干燥,得到CrCl3·6H2O。下列物质中可以用来洗涤CrCl3·6H2O的是_________(填序号)。
A.水 B.盐酸 C.乙醇 D.乙醚
【答案】pH试纸 HCl+NaOH=NaCl+H2O 避免后续操作中消耗过多的盐酸 降温结晶 D
【解析】
(1)测定溶液的pH值可用pH试纸或pH剂,加入的氢氧化钠与盐酸反应生成氯化钠和水,化学方程式为:HCl+NaOH=NaCl+H2O;
(2)“碱溶”步骤后,氢氧化钠还要被除去,如果过量太多,后续操作中消耗过多的盐酸,造成浪费;
(3)由于Cr(OH)3是一种难溶于水的碱;CrCl3·6H2O不溶于乙醚,易溶于水、乙醇,过滤后所得Cr(OH)3用过量的盐酸溶解,最后将CrCl3的HCl溶液进行蒸发浓缩、冷却结晶、过滤并用乙醚洗涤2~3次,即得CrCl36H2O晶体。

 精英口算卡系列答案
精英口算卡系列答案【题目】某同学向一定质量的石灰石中加入7.3%的稀盐酸来制取二氧化碳,测得反应过程中溶液的pH与加入的稀盐酸的关系如下图所示。
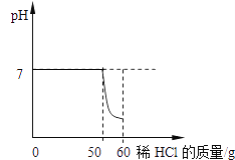
(1)该同学能收集到的二氧化碳的质量________?(写出计算过程)
(2)该同学把制取气体后的废液过滤,向滤液中加入10.6%的Na2CO3溶液,测得加入的Na2CO3溶液与产生的沉淀数据如下:
Na2CO3溶液质量/g | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
沉淀质量/g | 0 | 1 | n | 3 | 4 | 5 | m |
则m=________。加入10gNa2CO3溶液时发生反应的化学方程式是________。