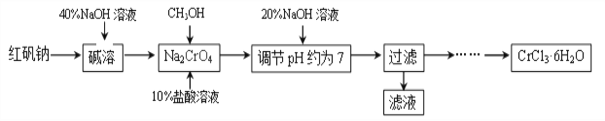
题目内容
【题目】某同学向一定质量的石灰石中加入7.3%的稀盐酸来制取二氧化碳,测得反应过程中溶液的pH与加入的稀盐酸的关系如下图所示。
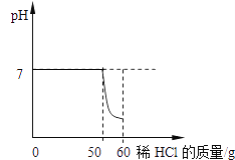
(1)该同学能收集到的二氧化碳的质量________?(写出计算过程)
(2)该同学把制取气体后的废液过滤,向滤液中加入10.6%的Na2CO3溶液,测得加入的Na2CO3溶液与产生的沉淀数据如下:
Na2CO3溶液质量/g | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
沉淀质量/g | 0 | 1 | n | 3 | 4 | 5 | m |
则m=________。加入10gNa2CO3溶液时发生反应的化学方程式是________。
【答案】2.2g5Na2CO3+CaCl2=CaCO3↓+2NaCl
【解析】
(1)根据图示可知与碳酸钙反应的HCl的质量=50g×7.3%=3.65g,结合方程式可以计算二氧化碳的质量;(2)根据图表可知前10gNa2CO3溶液加入后没有生成沉淀,是Na2CO3与过量的盐酸反应,之后每消耗10gNa2CO3溶液产生1g沉淀,所以n=2,再根据氯化钙的质量分析生成沉淀的最大量,分析m的数值。
(1)设生成的二氧化碳的质量为x,生成氯化钙的质量为y
与碳酸钙反应的HCl的质量=50g×7.3%=3.65g
CaCO3+2HCl=CaCl2+H2O+CO2↑
73 111 44
3.65g y x
![]() x=2.2g
x=2.2g ![]() y=5.55g
y=5.55g
(2)设加入足量Na2CO3溶液后生成碳酸钙的质量为z,
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 100
5.55g z![]()
z=5g
当加入60gNa2CO3溶液时,已经生成沉淀5g,说明已经恰好反应,当加入70gNa2CO3溶液时,不再发生反应,生成沉淀也应该是5g,所以m=5;
根据图表可知前10gNa2CO3溶液,是Na2CO3与过量的盐酸反应,化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑

 口算能手系列答案
口算能手系列答案【题目】某校化学兴趣小组的同学在学习了空气后,对液态空气的气化产生了兴趣,并在老师的指导下进行了探究活动.
提出问题:液态空气气化首先分离出来的是什么气体?
猜想和假设:甲同学认为首先分离出来的是氧气
乙同学认为首先分离出来的是氮气
实验探究:
实验操作 | 实验现象 | 实验结论 |
![]() 用集气瓶收集一瓶先气化出来的气体;
用集气瓶收集一瓶先气化出来的气体;
![]() ______________
______________
甲同学的猜想是错的得出结论:根据实验分析,液态空气气化首先分离出来的是________,该气体具有的化学性质是________.