题目内容
【题目】某温度下,140g饱和KNO3溶液中含有40g KNO3.若向此溶液中添加25g KNO3和50g水,保持温度不变,下列判断正确的是( )
①所得溶液是饱和溶液
②所得溶液是不饱和溶液
③所得溶液的溶质质量分数是28.6%
④所得溶液的质量分数是30.2%
A. ①②B. ①③C. ②③D. ③④
【答案】B
【解析】
①140g饱和KNO3溶液中含有40g硝酸钾,说明100g水中溶解40g硝酸钾恰好饱和,50g水中溶解20g硝酸钾恰好饱和,若向此溶液中添加25g KNO3和50g水,保持温度不变,所得溶液是饱和溶液,该选项说法正确;
②所得溶液是饱和溶液,该选项说法不正确;
③所得溶液的溶质质量分数是:![]() ×100%≈28.6%,该选项说法正确;
×100%≈28.6%,该选项说法正确;
④所得溶液的质量分数不是30.2%,该选项说法不正确。
故选B。

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
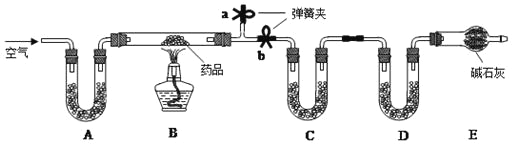
金博士一点全通系列答案【题目】某石灰石样品中的杂质既不溶于水也不与盐酸反应。现称取40g石灰石样品,等分为4份(分别编号为①②③④),每份样品分别与一定量的稀盐酸反应,所得数据如表所示:
样品编号 | ① | ② | ③ | ④ |
稀盐酸的质量/g | 25 | 50 | m | 150 |
剩余固体的质量/g | 7.5 | 5 | 2 | 2 |
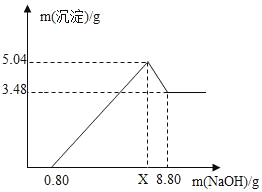
将编号③所得溶液过滤,取滤液质量的![]() 于烧杯中,向其中不断滴加质量分数为10.6%的碳酸钠溶液直至沉淀不再产生为止,有关沉淀质量的变化如图所示,请回答下列问题:
于烧杯中,向其中不断滴加质量分数为10.6%的碳酸钠溶液直至沉淀不再产生为止,有关沉淀质量的变化如图所示,请回答下列问题:
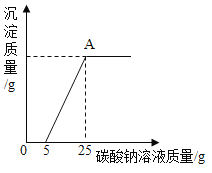
(1)该石灰石样品的纯度为_____;盐酸溶液的溶质质量分数为_____。
(2)编号③所用的稀盐酸的质量m为多少_____?
(3)A点处对应的溶液中溶质是_____(用化学式表示)。
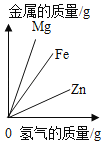
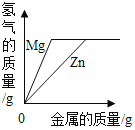
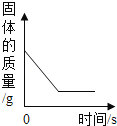
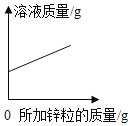
【题目】下列图象能正确反映对应变化关系的是( )
|
|
|
|
Mg、Zn、Fe与稀盐酸反应 | 等质量等质量分数的盐酸与足量的镁粉、锌粉 | 将铜片加入一定量的硝酸银溶液中 | 向一定质量的氯化锌和盐酸溶液中加入锌粒 |
A. A B. B C. C D. D