题目内容
【题目】工业利用如下反应合成SO3:2SO2+O2=2SO3。一定条件下,在一密闭容器内投入SO2、O2、SO3、V2O5四种物质,在不同时刻测得各物质的质量(单位为克)如下表所示。下列说法不正确的是
甲 | 乙 | 丙 | 丁 | |
t1 | 100 | 5 | 80 | 5 |
t2 | 60 | 55 | a | b |
t3 | 40 | c | d | 5 |
A.参加反应的SO2和O2的分子个数比为2∶1
B.丁物质一定是催化剂V2O5
C.丙物质是O2
D.d=15
【答案】D
【解析】
A、反应的化学方程式为2SO2+O2=2SO3,故参加反应的SO2和O2的分子个数比为2∶1,正确;
B、反应的化学方程式为2SO2+O2=2SO3,可知V2O5未参与反应,是该反应的催化剂,而丁物质反应前后的质量不变,故丁物质为催化剂V2O5;
C、由质量守恒定律可知t1、t2和t3的物质的总质量保持不变;故100g+5g+80g=60g+55g+a,a=70g,则t1到t2消耗了100g-60g=40g甲,消耗了80g-70g=10g丙,而反应方程式中二氧化硫的相对分子质量比氧气大,故二氧化硫消耗的量比氧气消耗的量更大,则甲是二氧化硫,丙是氧气,正确;
D、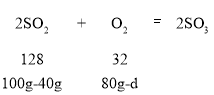 ;
; ![]() ;解得d=65g,错误。
;解得d=65g,错误。
故选D。

练习册系列答案
相关题目
【题目】下列对主题知识的归纳,完全正确的是
A | 化学与生活 | B | 化学与工业 |
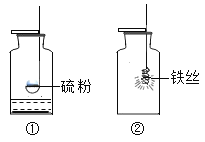
①区分软水与硬水:加入等量肥皂水振荡 ②区分羊毛纤维与合成纤维:灼烧闻气味 | ①焊接铁制品前用盐酸除表面的铁锈 ②用熟石灰处理含酸超标的污水 | ||
C | 化学符号与其表示意义 | D | 化学与安全 |
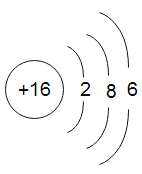
①氧化镁中氧元素的化合价: ②S2-结构示意图: ③一个钙离子:Ca2+ | ①加油站内:严禁烟火 ②油锅着火:用水浇灭 ③菜窖取菜:须做灯火实验 |
A.AB.BC.CD.D