题目内容
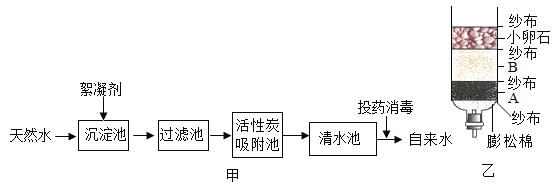
【题目】图中的A~I表示几种初中化学常见的物质,分别是由H、C、O、Al、Ca、Cu中的一种或几种元素组成。其中F、G、H、I均属于单质,B、D、E属于氧化物;A是实验室常用的燃料;D中两种元素质量比为5∶2;G具有很好的抗腐蚀性能。图中“—”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;部分反应物、生成物或反应条件已略去。
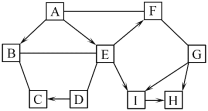
(1)写出化学式:A_____,D_____。
(2)写出B和C反应的化学方程式_____。
(3)写出G→I反应的化学方程式_____。
(4)G→H和I→H所属基本反应类型是_____。
【答案】C2H5OH CaO CO2+Ca(OH)2=CaCO3↓+H2O 2Al+6HCl=2AlCl3+3H2↑(或2Al+3H2SO4=Al2(SO4)3+3H2↑) 置换反应
【解析】
A是实验室常用的燃料,推测A是乙醇;D属于氧化物,且D中两种元素质量比为5∶2,推测D是氧化钙;G属于单质,且具有很好的抗腐蚀性能,推测G是铝;乙醇能生成B、E两种氧化物,则可能是乙醇燃烧生成二氧化碳和水;D是氧化钙,能生成C,则C可能是氢氧化钙;B和C能反应,则B是二氧化碳,E是水;E能生成F和I两种单质,且F能和铝反应,则可能是水电解产生氢气和氧气,F是氧气,I是氢气;H是单质,且氢气和铝能生成H,推测H是铜。验证可知推理正确。
(1)A是乙醇,化学式为C2H5OH;D是氧化钙,化学式为CaO;
(2)B是二氧化碳,C是氢氧化钙,二者反应生成碳酸钙和水,反应的化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O;
(3)G是铝,I是氢气,G→I可能是铝和酸反应生成氢气,如果铝和稀盐酸反应,化学方程式为2Al+6HCl=2AlCl3+3H2↑;如果铝和稀硫酸反应,化学方程式为2Al+3H2SO4=Al2(SO4)3+3H2↑;
(4)铝和酸反应生成氢气、氢气和氧化铜反应生成铜,都属于置换反应。

 阅读快车系列答案
阅读快车系列答案【题目】工业利用如下反应合成SO3:2SO2+O2=2SO3。一定条件下,在一密闭容器内投入SO2、O2、SO3、V2O5四种物质,在不同时刻测得各物质的质量(单位为克)如下表所示。下列说法不正确的是
甲 | 乙 | 丙 | 丁 | |
t1 | 100 | 5 | 80 | 5 |
t2 | 60 | 55 | a | b |
t3 | 40 | c | d | 5 |
A.参加反应的SO2和O2的分子个数比为2∶1
B.丁物质一定是催化剂V2O5
C.丙物质是O2
D.d=15