��Ŀ����
����Ŀ����������⣩���ֽ����Ļ��ǿ�����������أ�
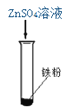
�ṩ��ҩƷ�У����ۡ�ͭ˿��п����20%ϡ���ᡢCuSO4��Һ��ZnSO4��Һ��FeSO4��Һ
ͬѧ�Ƿֳɼ������������ʵ�顣
��1������ͬѧ������·�������ʵ�飺
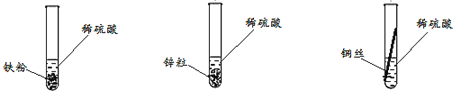
������ͬѧ������ԣ�������_______________________________��
��2������ͬѧ������·�������ʵ�飺
ʵ�鲽�� |
|
|
ʵ������ | �����Ա仯 | ______________ |
ʵ����� | _______________________________ | |
������Ӧ�Ļ�ѧ����ʽΪ_______________________________��
����ͬѧ����֧�Թ��е����ʵ���һ���ྻ���ձ��У������ձ��ڵĺ�ɫ�����������ࡣ��ַ�Ӧ����ˣ�ͬѧ���ֶ������ijɷ�չ����̽����
���������룩����һ ������һ����ͭ ����� _______________
ʵ�鲽�� | �������м���______________ |
ʵ������ | �����ݲ��� |
ʵ����� | �������ȷ |
��ʱ��Һ�к��е�������______________���ѧʽ����
����չ���죩ͨ��ѧϰͬѧ�������˱ȽϽ�����Ե���ȷ������ͬʱ��ѡ������һ���Լ�_______________________����һ����֤�����ֽ����Ļ��ǿ����
���𰸡����ý�������״��С��ͬ�����ܱȽ��к�ɫ������������Һ����ɫ��Ϊdz��ɫZn>Fe>CuFe + CuSO4 = FeSO4 + Cu������һ��������ͭϡ����ZnSO4��FeSO4п����FeSO4��Һ��ͭ˿ �� п�� ��FeSO4��Һ�� ���ۡ� CuSO4��Һ
��������
���������(1)�Ա�����ҩƷ������֪�����ý�������״��С��ͬ���������жϣ�
(2)�����м�������п��Һ������������˵��������п���ã���������ͭ��Һ��Ӧ����ͭ��������������Ӧ�Ļ�ѧ����ʽΪ��Fe+CuSO4=FeSO4+Cu���۲쵽���к�ɫ������������Һ����ɫ��Ϊdz��ɫ��˵��ͭ���������ã��������������ֽ����Ļ��Ϊ��Zn>Fe>Cu��
������������������п��Һ����Ӧ����������ͭ��Һ��Ӧ����ͭ������������������һ����ͭ��ͭ������������һ������ͭ����Ҫȷ���Ƿ����������������ᷴӦ���������������������ʿ��Լ������ᣬ�۲��Ƿ������ݲ������������ݲ�������������ͭ���������ݲ�������ͭ����������п��Һ����Ӧ������Һ��һ��������п����������ͭ��Һ��Ӧ����ͭ��������������ʣ�࣬����Һ��һ��������������û������ͭ���������ʵĻ�ѧʽΪ��ZnSO4��FeSO4��
��չ���죺�������ṩ��ҩƷ������Zn��Fe��Cu���ֽ����Ļ��ǿ��˳���������-п����FeSO4��Һ��ͭ˿ �� п�� ��FeSO4��Һ�� ���ۡ� CuSO4��ҺҲ�ܽ�����֤��

����Ŀ��ijʵ��С���ͬѧΪ�˲ⶨʵ�������������Ʒ�Ĵ��ȣ�ȡһ�������ĸ���Ʒ��1g�������̻�ϣ���������Ϊ6g.���μ��ȸû����t1��t2��t3��t4ʱ��ֱ���ȴ����ʣ�������������¼���й��������±�����Ʒ�е����ʲ����뻯ѧ��Ӧ����
����ʱ�� | t1 | t2 | t3 | t4 |
ʣ���������/g | 4.24 | 4.16 | 4.08 | 4.08 |
�Լ��㣺
��1����ȫ��Ӧ�������������������Ϊ_______��
��2����Ʒ������صĴ����Ƕ���_______��