题目内容
(8分)某环保小组监测到一工厂排放的废水中含有H2SO4和CuSO4 。为了测定废水中CuSO4的质量分数,该小组取了100g废水,逐滴加入10%的NaOH溶液至过量。测得生成Cu(OH)2沉淀质量与所加NaOH溶液质量关系如下图所示。

(1)与H2SO4反应的NaOH溶液质量为 g;100g废水中H2SO4的质量为 g。
(2)计算废水中CuSO4的质量分数。

(1)与H2SO4反应的NaOH溶液质量为 g;100g废水中H2SO4的质量为 g。
(2)计算废水中CuSO4的质量分数。
试题分析: 解:(1)由关系图可知,有8gNaOH溶液与废水中的硫酸发生反应;
故与H2SO4反应的NaOH溶液质量为8g×10%=0.8g
设废水中硫酸质量为x
2NaOH+H2SO4=Na2SO4+2H2O
80 98
8g×10% x
80:98=8g×10%:X
X=0.98g
(2)设废水中的硫酸铜的质量为Y
CuSO4+2NaOH==Cu(OH)2↓+Na2SO4
80
Y (24g-8g)×10%
160:80=Y:(24g-8g)×10%
Y=3.2g
废水中CuSO4的质量分数为:
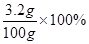 =3.2%
=3.2%答:(1)与H2SO4反应的NaOH溶液质量为0.8g;100g废水中H2SO4的质量为0.98g;(2)计算废水中CuSO4的质量分数为3.2%

练习册系列答案
相关题目

