题目内容
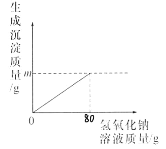
【题目】向一定质量的MgSO4溶液中先后滴加100克Ba(OH)2、H2SO4溶液,过程中加入溶液的质量与产生沉淀的质量关系如图所示。

下列说法正确的是
A. a点对应的溶液pH<7
B. b点溶液中的溶质有2种
C. m=23.3
D. Ba(OH)2溶液溶质质量分数一定等于34.2%
【答案】BD
【解析】
硫酸镁和氢氧化钡反应生成硫酸钡沉淀和氢氧化镁沉淀,硫酸钡沉淀不溶于酸,氢氧化镁和硫酸反应生成硫酸镁和水。根据图示可知,氢氧化钡过量。加入100g氢氧化钡后得到了氢氧化钡、氢氧化镁、硫酸钡的混合物,再加入100g硫酸时,硫酸先消耗氢氧化钡,当氢氧化钡完全消耗后,硫酸再与氢氧化镁反应生成硫酸镁和水。硫酸过量。
A、通过上述分析可知,a点发生的反应氢氧化钡与硫酸反应,氢氧化钡没有完全反应,此时溶液呈碱性,溶液pH>7,故A错误;
B、根据图像可知,b点时反应已完全,溶液中的溶质是硫酸镁和过量的硫酸,溶液中的溶质有2种,故B正确;
C、根据图像可知,反应过程中生成了46.6g硫酸钡,氢氧化镁的质量=52.4g-46.6g=5.6g。
设:生成5.6g氢氧化镁沉淀同时生成硫酸钡的质量为x。
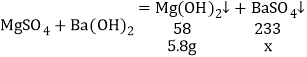
![]() x=23.3g
x=23.3g
所以m=5.8g+23.3g=29.1g,故C错误;
D、设:生成46.6g的硫酸钡,需要氢氧化钡的质量为y。

![]() y=34.2g;Ba(OH)2溶液的溶质质量分数=
y=34.2g;Ba(OH)2溶液的溶质质量分数=![]() ,故D正确。故选BD。
,故D正确。故选BD。

 阅读快车系列答案
阅读快车系列答案【题目】蜡烛(主要含碳、氢、氧元素)在密闭容器中熄灭的原因是什么?燃烧的产物是什么?
(1)小敏认为蜡烛熄灭的原因是燃烧消耗完了容器内的氧气,并对燃烧产物提出猜想:
①燃烧的产物可能有二氧化碳。
②燃烧的产物可能有水。
除了上述猜想,你的猜想:燃烧的产物可能有________。
(2)实验一:在密闭容器中点燃蜡烛至熄灭,抽取10mL密闭容器中的气体,注入到试管中的饱和澄清石灰水中,发现石灰水始终没有变浑浊。从科学性考虑,下一步是_________(选填字母)。
A 直接得到燃烧产物中没有二氧化碳的结论
B 再多抽取一些气体注入到试管中的石灰水中
C 增加饱和澄清石灰水的质量
(3)实验二:在老师的指导下,利用多功能传感器进行有关量的测量,装置如图所示。实验结束后,铝板表面有黑色固体颗粒,同时传感器采得实验前后的有关数据如表所示:

相对湿度 | 氧气含量 | 二氧化碳含量 | 一氧化碳含量 | |
蜡烛点燃前 | 48.4% | 18.7% | 0.058% | 0 |
蜡烛熄灭后 | 71.6% | 15.6% | 3.643% | 0.0182% |
由实验及结果分析:
①密闭容器内蜡烛熄灭的原因是________;
②蜡烛燃烧生成的产物是________。