题目内容
【题目】某同学将H2O2与氧化铁粉末混合,发现有大量气泡产生,他联想到MnO2可作为H2O2分解的催化剂,氧化铁能否作为H2O2分解的催化剂?请一起参与探究。
(猜想)氧化铁能作为H2O2分解的催化剂。
(实验验证)甲同学设计了三个实验,请将表格填写完整:
操作 | 现象 | 结论 | |
实验一 | 取一定量的H2O2溶液于试管中,伸入带火星的木条。 | 有极少量的气泡产生,木条不复燃。 | _____________________ |
实验二 | 在实验一的试管中加入Wg氧化铁粉末,伸入带火星的木条。 | 有大量气泡产生,木条复燃。 | _____________________ |
实验三 | 待反应结束后,将试管里的不溶物滤出,并洗涤,干燥,称量。 | 固体质量仍为Wg。 | _____________________ |
(实验结论)甲同学认为氧化铁粉末可以作为H2O2分解的催化剂,请写出该反应的文字表达式 _____________________。
(反思评价)乙同学认为要证明甲同学的结论正确,仅做这三个实验还不充分,需再补充一个探究实验,探究_________________________________,写出你设计的实验操作___________________。
(拓展)下表是丙同学探究影响H2O2分解因素时所记录的部分数据。
浓度 时间 催化剂 | 30﹪的H2O2溶液 | 15﹪的H2O2溶液 | 5﹪的H2O2溶液 |
加入Wg MnO2 | 0.2 | 0.8 | 2.0 |
加入Wg氧化铁 | 7.0 | 9.0 | 16.0 |
表格-用足量等体积H2O2溶液制取相同体积O2所需的时间通过对数据的分析,你能得出的结论是:____________________________ 。
【答案】过氧化氢溶液在常温下产生氧气速度慢 氧化铁加快了过氧化氢分解的速度 反应前后氧化铁质量不变 ![]() 氧化铁化学性质是否改变 取实验三的固体于试管中,加入一定量的H2O2溶液于试管中,伸入带火星的木条,如果产生大量气泡,木条复燃,说明氧化铁化学性质在反应前后不变 相同条件下,MnO2的催化效果比Fe2O3好(或其他条件相同的情况下,H2O2浓度越大,产生氧气的速率越快)
氧化铁化学性质是否改变 取实验三的固体于试管中,加入一定量的H2O2溶液于试管中,伸入带火星的木条,如果产生大量气泡,木条复燃,说明氧化铁化学性质在反应前后不变 相同条件下,MnO2的催化效果比Fe2O3好(或其他条件相同的情况下,H2O2浓度越大,产生氧气的速率越快)
【解析】
过氧化氢在二氧化锰催化作用下生成水和氧气, 过氧化氢在氧化铁催化作用下生成水和氧气。
[实验验证]过氧化氢在二氧化锰催化作用下生成水和氧气,氧气能使带火星的木条复燃。
操作 | 现象 | 结论 | |
实验一 | 取一定量的H2O2溶液于试管中,伸入带火星的木条。 | 有极少量的气泡产生,木条不复燃。 | 过氧化氢溶液在常温下产生氧气速度慢 |
实验二 | 在实验一的试管中加入Wg氧化铁粉末,伸入带火星的木条。 | 有大量气泡产生,木条复燃。 | 氧化铁加快了过氧化氢分解的速度 |
实验三 | 待反应结束后,将试管里的不溶物滤出,并洗涤,干燥,称量。 | 固体质量仍为Wg。 | 反应前后氧化铁质量不变 |
[实验结论] H2O2在氧化铁催化作用下生成水和氧气,反应的文字表达式为![]() 。
。
[反思评价] 催化剂在反应前后本身质量和化学性质都不变,所以不仅考虑反应前后氧化铁质量不变,还需要考虑化学性质是否改变,故补充探究实验是氧化铁化学性质是否改变,设计的实验操作为:取实验三的固体于试管中,加入一定量的H2O2溶液于试管中,伸入带火星的木条,如果产生大量气泡,木条复燃,说明氧化铁化学性质在反应前后不变。
[拓展]表格-用足量等体积H2O2溶液制取相同体积O2所需的时间通过对数据的分析,能得出的结论是相同条件下,MnO2的催化效果比Fe2O3好(或其他条件相同的情况下,H2O2浓度越大,产生氧气的速率越快)。

 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案【题目】某研究小组在学习氧气的化学性质时发现:铁丝燃烧没有火焰,蜡烛燃烧却有明亮的火焰。该小组同学进行了如下探究。
(1)写出铁丝在氧气中燃烧的文字表达式:_____。已知铁丝燃烧生成四氧化三铁。
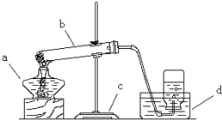
(2)探究一:蜡烛燃烧产生火焰的原因是什么?点燃蜡烛,将金属导管一端伸入内焰,导出其中物质,在另一端管口点燃,也有火焰产生(如图所示)。

由此可知:蜡烛燃烧产生的火焰是由_____(填“固态”或“气态”)物质燃烧形成的。
(3)探究二:物质燃烧产生火焰的根本原因是什么?
(查阅资料)
物质 | 熔点/℃ | 沸点/℃ | 燃烧时温度/℃ |
石蜡 | 50~70 | 300~550 | 约600 |
铁 | 1535 | 2750 | 约1800 |
钠 | 97.8 | 883 | 约1400 |
由上表可知:物质燃烧能否产生火焰与其_____(填“熔点”或“沸点”)和燃烧时温度有关。由此推测:钠在燃烧时,_____(填“有”或“没有”)火焰产生。