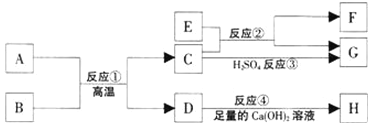
题目内容
【题目】下列应用的原理( 用化学方程式表示)及基本反应类型均正确的是( )
A.用红磷测定空气中氧气含量:4P+5O2![]() 2P2O5 氧化反应
2P2O5 氧化反应
B.用赤铁矿高炉炼铁:Fe2O3+3CO![]() 2Fe+3CO2 置换反应
2Fe+3CO2 置换反应
C.硫酸厂污水可用熟石灰中和处理:H2SO4+Ca(OH)2 = CaSO4+H2O 复分解反应
D.加热高锰酸钾制取氧气:2KMnO4![]() K2MnO4+MnO2+ O2↑ 分解反应
K2MnO4+MnO2+ O2↑ 分解反应
【答案】D
【解析】
本题主要考查化学方程式和基本反应类型,基本反应类型包括化合反应(A+B+……=C)、分解反应(A=B+C+……)、置换反应(A+BC=AC+B)和复分解反应(AB+CD=AD+CB)。
A. 测定空气中氧气含量的实验药品就是红磷,利用红磷燃烧消耗装置中的氧气,从而产生压强差,水进入集气瓶的体积就是消耗的氧气体积,方程式就是红磷燃烧的方程式:4P+5O2![]() 2P2O5 ,但是该方程式的基本反应类型是化合反应,氧化反应不属于基本反应类型,故A选项不符合题意;
2P2O5 ,但是该方程式的基本反应类型是化合反应,氧化反应不属于基本反应类型,故A选项不符合题意;
B. 赤铁矿的主要成分就是氧化铁,高炉炼铁的方程式:Fe2O3+3CO![]() 2Fe+3CO2 ,该反应不属于四种基本反应类型中的任何一种,置换反应是基本反应类型之一,故B选项不符合题意;
2Fe+3CO2 ,该反应不属于四种基本反应类型中的任何一种,置换反应是基本反应类型之一,故B选项不符合题意;
C. 硫酸厂污水主要含有溶质是H2SO4,熟石灰主要成分是Ca(OH)2,硫酸厂污水中加入熟石灰利用酸碱中和反应原理处理污水,发生反应方程式就是:H2SO4+Ca(OH)2 = CaSO4+2H2O,这两种化合物H2SO4和Ca(OH)2在溶液中反应时,互换了阴阳离子生成另外两种化合物CaSO4和H2O,符合复分解反应的特点:两种化合物在溶液中相互交换阴阳离子,生成另外两种化合物。而C选项中方程式没有配平,故C选项不符合题意;
D.高锰酸钾在加热条件下制取氧气,反应的方程式:2KMnO4![]() K2MnO4+MnO2+ O2↑是正确的,该反应属于分解反应,故D选项符合题意。
K2MnO4+MnO2+ O2↑是正确的,该反应属于分解反应,故D选项符合题意。
故选:D。

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案【题目】某化学兴趣小组为测定大理石中碳酸钙的含量,进行如图1所示实验:
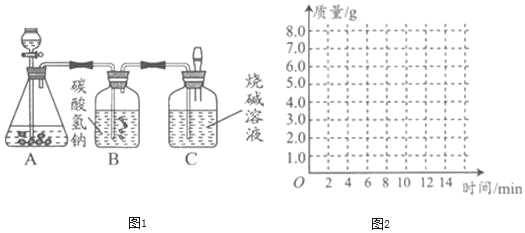
将过量的稀盐酸加入到20 g大理石中(其他成分不与盐酸反应),把产生的CO2气体用足量的烧碱溶液吸收,同时测量C瓶烧碱溶液增加的质量,结果如下表所示:
时间/分 | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
C增加质量/g | 0 | 3.0 | 5.0 | 6.0 | 6.6 | x | 6.6 |
(1)上表中,第10分钟时,x=_____。
(2)计算大理石样品中碳酸钙的质量分数_____。(要写计算过程)
(3)请在如图的坐标纸上,以时间为横坐标,以产生CO2气体的质量为纵坐标,画出能够表明产生气体的质量随时间变化规律的关系曲线_____。
(4)B中所装药品为碳酸氢钠溶液,作用是吸收挥发出的HCl气体,该装置使测量结果_____(填“偏大”“偏小”或“没有影响”)。
【题目】某化学兴趣小组在实验室做课外探究实验。如图所示,他们将一只烧杯罩在2支燃着的高低不同的蜡烛上,发现总是高的蜡烛先熄灭,请你随他们一起探究。
[提出问题]为什么高的蜡烛先熄灭?
[猜想假设]猜想1:__________________。
猜想2:上部的氧气被消耗。
[实验验证1]为了验证猜想1是否正确,小明同学进行了如下实验:
步骤 | 现象 | 结论 |
将浸有澄清石灰水的滤纸分别放在烧杯的顶部和底部,在滤纸上滴加酚酞溶液,变色后,用烧杯罩住点燃的高低蜡烛,观察高低滤纸褪色顺序。 | ____________________ | 烧杯上层二氧化碳浓度较高,高蜡烛先熄灭与二氧化碳浓度过高有关。涉及到的化学方程式是______________ |
[实验分析]小红对小明的结论表示怀疑,她用如图1装置收集一瓶80%二氧化碳与20%氧气的混合气体,最右边的仪器名称是____________;将燃着的短蜡烛自上而下缓慢伸入收集的混合气体瓶中,发现____________,从而证明小明的结论不正确。

[实验验证2]为了验证猜想2,小红利用手持技术实验,用氧气、二氧化碳传感器在烧杯顶部测量烧杯内两支蜡烛从点燃到全部熄灭后,烧杯内氧气和二氧化碳的浓度变化,如图2所示。剩余氧气浓度15. 65%,二氧化碳浓度1. 898%。二氧化碳浓度增大不多,而氧气浓度明显下降。
[实验结论]____________________________________________。
[反思评价]根据图2中上面一条曲线(装置内氧气浓度)变化分析,在__________(填 “A”“B”“C”或“D” )点时蜡烛全部熄灭;请解释曲线AB段、BC段、CD段变化的原因。
AB段:_______________________________。
BC段:_______________________________。
CD段:_______________________________。