题目内容
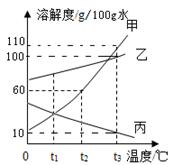
如图为KNO3 和NaCl两种物质的溶解度曲线。

(1)t1℃时,两种物质溶解度的大小关系:NaCl KNO3(填“>”或“=”或“<”)。
(2)t2℃时,将25g氯化钠固体投入50g水中,充分溶解后可得到NaCl 溶液(填“不饱和”或“饱和”或“不能确定”)。
(3)将饱和KNO3溶液变为不饱和KNO3溶液,可行的方法之一是添加溶剂(水),还可以是 。
(4)将t2℃时饱和的KNO3溶液100 g恒温蒸发10 g水,可析出KNO3 的质量为 g,剩下的溶液中的质量分数为 。
(5)把t2℃时150g KNO3的饱和溶液稀释为20%,需加水 g。
(6)现有t2℃时含KNO3和NaCl两种溶质的饱和溶液,若要得到较纯净的NaCl晶体,应采取的物理方法是 。
(7)你从图中还可获得什么信息(写出一条即可): 。

(1)t1℃时,两种物质溶解度的大小关系:NaCl KNO3(填“>”或“=”或“<”)。
(2)t2℃时,将25g氯化钠固体投入50g水中,充分溶解后可得到NaCl 溶液(填“不饱和”或“饱和”或“不能确定”)。
(3)将饱和KNO3溶液变为不饱和KNO3溶液,可行的方法之一是添加溶剂(水),还可以是 。
(4)将t2℃时饱和的KNO3溶液100 g恒温蒸发10 g水,可析出KNO3 的质量为 g,剩下的溶液中的质量分数为 。
(5)把t2℃时150g KNO3的饱和溶液稀释为20%,需加水 g。
(6)现有t2℃时含KNO3和NaCl两种溶质的饱和溶液,若要得到较纯净的NaCl晶体,应采取的物理方法是 。
(7)你从图中还可获得什么信息(写出一条即可): 。
(1)> (2)饱和 (3)升温 (4)5 33.3% (5)100 (6)蒸发 (7)合理即可
试题分析:根据溶解度曲线可知,(1)t1℃时,两种物质溶解度的大小关系:NaCl>KNO3;因为t2℃时氯化钠的溶解度小于50g;所以(2)t2℃时,将25g氯化钠固体投入50g水中,充分溶解后可得到NaCl的饱和溶液;因为硝酸钾的溶解度随温度的升高而增大,故(3)将饱和KNO3溶液变为不饱和KNO3溶液,可行的方法之一是添加溶剂(水),还可以是升温;因为恒温蒸发析出晶体,得到的溶液仍为饱和溶液,所以(4)可析出KNO3 的质量为5g,剩下的溶液中的质量分数为50g/150g×100%=33.3%;(5)把t2℃时150g KNO3的饱和溶液稀释为20%,根据溶液稀释前后溶质的质量不变,150g×33.3%=(150g+X)×20%,的需加水为100g;(6)现有t2℃时含KNO3和NaCl两种溶质的饱和溶液,若要得到较纯净的NaCl晶体,根据氯化钠的溶解度随温度变化不大的趋势,得出采取的物理方法是蒸发;(7)你从图中还可获得什么信息;从混合物溶液中得到硝酸钾的方法为降温结晶.

练习册系列答案
相关题目