题目内容
【题目】如图是a、b、c三种物质的溶解度曲线,请回答下列问题:

(1)p点的含义是___________。
(2)若a物质中混有少量的b物质,可用____方法提纯a。
(3)t3℃时,把80g物质a加入到200g水中充分搅拌、静置,形成的溶液质量为____________g。
(4)t3℃时,将a和b的饱和溶液降到t1℃时,析出晶体的质量关系正确的是________(填字母序号)。
A.a>b B.a=b C.a<b D.不能确定
(5)要使t2℃时C的饱和溶液变为不饱和溶液,可采用的一种方法是______________。
(6)将t2℃时的甲乙丙三种物质的饱和溶液降温至t1℃时,所得溶液中溶质的质量分数由大到小的顺序是___________。
(7)分别将100ga、c的饱和溶液从T3℃降温到T1℃时,对所得溶液的叙述正确的是_____(填序号)
A.a,c都是饱和溶液 B.所含溶剂质量:a=c
C.溶液的质量:a>c D.溶质的质量分数:a>c
【答案】t1℃时a、c的溶解度相同均为20克 降温结晶 280g D 加水 b>a>c D
【解析】
(1)两条溶解度曲线的焦点的含义是指该温度下,两种物质的溶解度相同,故表示t1℃时a、c的溶解度相同均为20克。
(2)a物质的溶解度随温度的变化较大,b物质的溶解度随温度的变化较小,故a中混有少量b时,用降温结晶的方法提纯。
(3)t3℃时a物质的溶解度是50g,含义是在t3℃时,100g的水中最多可以溶解50g的a物质,故200g水中最多可以溶解100g的a物质,故将t3℃时,把80g物质a加入到200g水中充分搅拌、静置,形成的溶液质量为280g。
(4)t3℃时,将a和b的饱和溶液降到t1℃时,析出晶体的质量与a和b的饱和溶液的质量有关系,故无法确定,故选D。
(5)c物质的溶解度随温度的升高而降低,故可以加入水使c的饱和溶液变为不饱和溶液。
(6)将t2℃时的甲乙丙三种物质的饱和溶液降温至t1℃时,ab有晶体析出,c变为不饱和溶液,溶液中溶质的质量分数不变,t1℃时b的溶解度大于a的溶解度,故b中溶质的质量分数大于a中的溶质的质量分数,故大小书写为b>a>c。
(7)a物质的溶解度随温度的升高而升高,c的溶解度随温度的升高而降低,故将100ga、c的饱和溶液从T3℃降温到T1℃时,a为饱和溶液,有晶体析出,c为不饱和溶液,故A错误;在t3℃时,a 的溶解度大于c的溶解读,故100ga、c的饱和溶液中,a物质中的水的含量较少,在降温的过程中,水的质量不变,故c>a,故B错误;降温的过程中a中有晶体析出,c中没有,故溶液的质量c>a,故C错误;降温至t1℃,a为饱和溶液,c为不饱和溶液,故溶质的质量分数:a>c,故正确;故选D。

 高效智能课时作业系列答案
高效智能课时作业系列答案【题目】实验小组同学做了如下实验,验证质量守恒定律。
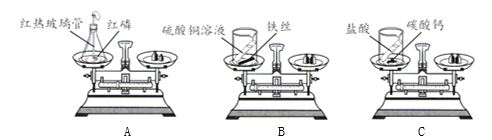
(1)实验A中发生反应的化学方程式为_______。
(2)上述实验中,不能用于验证质量守恒定律的是______(填实验序号),其原因是______。
【题目】下图是元素周期表的一部分,请根据表中提供的信息按要求填空:
3 Li 锂 | 4 Be 铍 | 5 B 硼 | ① | 7 N 氮 | ② | 9 F 氟 | 10 Ne 氖 |
11 Na 镁 | 12 Mg 镁 | ③ | 14 Si 硅 | ④ | 16 S 硫 | 17 Cl 氯 | 18 Ar 氩 |
(1)②号位置代表元素的核电荷数为______;
(2)磷的原子结构示意图为![]() , 则磷元素在上述周期表的位置为______;
, 则磷元素在上述周期表的位置为______;
(3)12号元素与17号元素形成化合物的化学式为_______;
(4)在元素周期表同一行中,元素的分布有什么特点_______。