题目内容
【题目】小明同学为了探究某赤铁矿的纯度,先后进行了三次实验,实验数据如下表
实验次数 | 第一次 | 第二次 | 第三次 |
所取铁矿石样品的质量/g | 20 | 20 | 40 |
所加稀硫酸的质量/g | 500 | 400 | 300 |
烧杯内剩余固体的质量/g | 4 | 4 | 24 |
根据晓明同学的实验,试回答以下问题: (赤铁矿石样品中所含杂质不与其它任何物质反应也不溶于水)
(1)实验中发生反应的化学方程式为___________。
(2)此赤铁矿石样品的纯度为____________。
(3)根据已知条件列出求解第三次实验中参加反应的硫酸质量(x) 的比例式____________。
(4)如果用98%的浓硫酸配制第二次实验所用稀硫酸,需加水的质量为__________________。
(5)将第三次实验后烧杯内物质过滤,向所得不饱和滤液中加入184g水后,则所得溶液的溶质质量分数为__________________。
(6)如果将第三次实验中的剩余固体经洗涤、干燥,并用足量的一氧化碳进行还原,则最终可得到固体的质量为__________________。
【答案】Fe2O3+3H2SO4=Fe2(SO4)3+3H2O 80% ![]() 360g 8% 11.2g
360g 8% 11.2g
【解析】
(1)赤铁矿的主要成分是氧化铁,氧化铁和硫酸反应生成硫酸铁和水,化学方程式为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
故填:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O。
(2)第一次实验中,赤铁矿中的氧化铁完全反应,所以此赤铁矿石样品的纯度为:![]() ;
;
故填:80%。
(3)第三次实验参加反应的氧化铁的质量为40g-24g=16g
设第三次实验参加反应的硫酸的质量为x,生成硫酸铁的质量为y
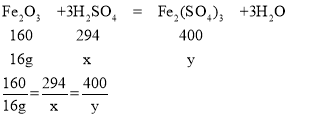
x=29.4g
y=40g
故填:![]() 。
。
(4)实验所用稀硫酸的质量分数为:![]()
如果用98%的浓硫酸配制第二次实验所用稀硫酸,设需加水的质量为a,则
9.8%×400g=(400g-a)×98%
a=360g
答:需加水的质量为360g。
故填:360g。
(5)由(3)可知,第三次实验生成硫酸铁的质量为40g,将第三次实验后烧杯内物质过滤,向所得不饱和滤液中加入184g水后,则所得溶液的溶质质量分数为:![]()
答:所得溶液的溶质质量分数为8%。
故填:8%。
(5)第一次和第二次实验说明20g赤铁矿中含有杂质4g,所以40g赤铁矿中含有杂质8g
设生成铁的质量为z
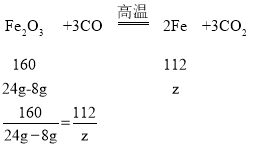
z=11.2g
答:成铁的质量为11.2g。
故填:11.2g。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案【题目】硼泥主要由MgO 和SiO2 组成,含有少量Fe2O3 、FeO 、Al2O3 等杂质。用硼泥生产氢氧化镁的工艺流程如图所示:
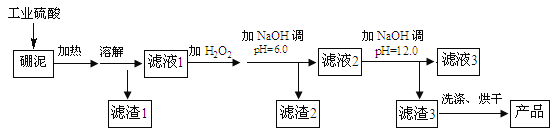
提示信息:
Ⅰ.加入H2O2的目的是将溶液中 Fe2+氧化为 Fe3+
Ⅱ.SiO2不与硫酸反应
Ⅲ.已知某些金属阳离子在溶液中生成氢氧化物沉淀的pH如下表所示,当溶液的pH达到完全沉淀值时,可以认为金属阳离子已完全沉淀。
氢氧化物 | 完全沉淀时的pH |
Mg(OH)2 | 10.8 |
Fe(OH)2 | 9.6 |
Fe(OH)3 | 3.7 |
Al(OH)3 | 4.7 |
(1)写出加热溶解中发生反应的其中一个化学方程式:____。
(2)滤液2中大量存在的金属离子是___。
(3)调节两次pH值的原因是___。
(4)利用Mg(OH)2与含SO2和O2的烟气反应生成MgSO4和另一种无污染的化合物,可以使烟气脱硫,请问另一种产物的化学式为___。
【题目】分类和类比是学习化学常用的方法。
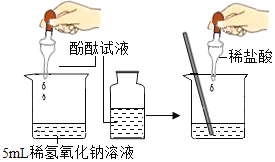
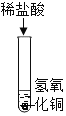
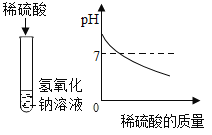
(1)下列实验都能探究酸与碱之间能否发生反应。请从“定性研究”或“定量研究”的角度,将下列实验中的A与_________(填字母)归为一类,理由是_____________。
|
在少量的氢氧化铜固体中加入足量的稀盐酸 |
在氢氧化钠溶液不断滴加稀硫酸,边加边用酸度计测定溶液的pH |
A | B | C |
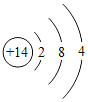
(2)非金属与氢气反应的条件越容易、反应越剧烈,则非金属元素的非金属性越强。据此规律,可推断出第三周期非金属元素的非金属性强弱的顺序为__________________;结构决定性质,请归纳位于第三周期元素的原子结构与元素性质的递变规律______________________。
元素 | Si | p | S | Cl |
单质与氢气的反应条件 | 高温 | 磷蒸气与氢气能反应 | 加热 | 加热或点燃时发生爆炸 |
原子核外电子排布 |
|
|
|
|