题目内容
【题目】木炭作为还原剂用于金属冶炼已有几千年历史。教材用如图Ⅰ所示实验介绍这一知识。

(知识回顾)
(1)木炭与氧化铜反应的化学方程式是_____,此反应中还原剂为_____。
(2)图Ⅰ中实验现象为_____。
A ①中黑色粉末变成红色
B ②中澄清的石灰水变浑浊
C ①中红色粉末变成黑色
D 生成二氧化碳气体
(3)图Ⅰ与教材中的装置还是略作了改进,实验结束时,可先用弹簣夹夹紧橡皮管,再熄灭酒精灯,这样做的目的除了防止石灰水倒吸入热的试管,避免试管炸裂外,还可以防止_____。
(拓展研究)
为了提高成功率,某研究小组设计如图Ⅱ方案进行实验。
分别称取2g木炭与CuO混合物,按每种比例重复实验3次,记录开始反应的时间及实验现象,实验记录如下表:
总质量相同(2g)但木炭与CuO比例不同的实验对比表 | |||||||
比例 | 1:6 | 1:7 | 1:8 | 1:9 | 1:10-1:11 | 1:12 | 1:13 |
加热时间 | 1′51″ | 1′43″ | 1′57″ | 2′21″ | 2′00″ | 1′53″ | 4′ |
实验现象 | 红热,产生大量气泡,石灰水变浑浊 | 偶尔红热,气泡较少 | |||||
实验结果 | 表层铜球较大,出现未完全反应的木炭粉末 | 反应较完全,生成网状铜块 | 部分生成Cu2O | 主要产物是Cu2O | |||
(4)装罩中酒精灯上的网罩作用是_____;
(5)由实验数据分析,除温度外,影响实验结果的因素是_____;
(6)从产物分析,该反应混合物的最佳比例范围是_____。
(装置改进)
(7)由于试管中有空气,实验时应注意:
①混合物需进行预热,除了使试管受热均匀外,另外的目的是_____。
②从理论上讲,并不能把石灰水变浑浊作为木炭跟CuO开始反应的充分证据。其理由是_____(用方程式表示)。
【答案】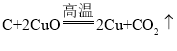 碳 AB 铜被重新氧化 使火焰更集中并提高温度 反应物的比例 1:10~1:11 减少试管内剩余空气的量,降低氧气对实验的影响
碳 AB 铜被重新氧化 使火焰更集中并提高温度 反应物的比例 1:10~1:11 减少试管内剩余空气的量,降低氧气对实验的影响 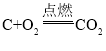
【解析】
(1)根据碳和氧化铜在高温的条件下生成铜和二氧化碳进行分析;
(2)根据碳还原氧化铜的实验现象分析;
(3)根据铜和氧气在加热的条件下生成氧化铜进行分析;
(4)根据加上灯罩可以使火焰更集中,提升温度进行分析;
(5)根据通过实验数据可以看出氧化铜和碳粉的比例不同,得到产物也不同;
(6)根据生成物分析,从实验结果中可以得出该题答案;
(7)①根据试管内有空气,空气中的氧气会消耗木炭进行分析;
②根据装置内有空气,在加热时遇到木炭会生成二氧化碳进行分析。
(1)碳和氧化铜在高温的条件下生成铜和二氧化碳,化学方程式为: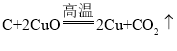 ,碳夺取氧化铜中的氧元素,生成二氧化碳,碳是还原剂;
,碳夺取氧化铜中的氧元素,生成二氧化碳,碳是还原剂;
(2)碳和氧化铜在高温的条件下生成铜和二氧化碳,氧化铜是黑色粉末,铜的颜色是红色,反应生成的二氧化碳使澄清的石灰水变浑浊,故图Ⅰ中碳还原氧化铜的实验现象为:①中黑色粉末变成红色;②中澄清的石灰水变浑浊;D选项生成二氧化碳气体属于实验结论,故选项A和B 正确;
(3)铜和氧气在加热的条件下生成氧化铜,所以除了防止石灰水倒吸入热的试管,使试管炸裂外,还可以防止铜被重新氧化;
(4)加上灯罩可以使火焰更集中,提升温度,利于反应的进行;
(5)实验研究:通过实验可以看出氧化铜和碳粉的比例不同,得到产物也不同,由实验数据分析,影响实验的另一因素是:反应物的比例;
(6)从实验结果中可以得出:反应物的比例为1:10~1:11时,反应较完全,生成网状铜块,故该反应混合物的最佳比例范围即反应最充分的是:1:10~1:11;
(7)①由于试管内有空气,混合物需进行预热,除了使试管均匀受热外,目的是:减少试管内剩余空气的量,降低氧气对实验的影响;
②由于装置内有空气,在加热时遇到木炭会生成二氧化碳,所以不能把石灰水浑浊作为木炭跟CuO反应的充分证据,试管中还可能发生反应:碳和氧气反应也会生成二氧化碳,反应的化学方程式为: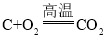 。
。