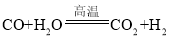题目内容
【题目】过氧化钙品体(CaO2·8H2O)较稳定,呈白色,微溶于水,广泛应用于环境杀菌消毒。以贝壳为原料制备CaO2的流程如下:
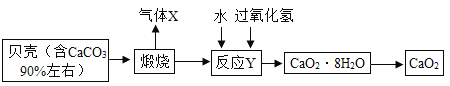
(1)过氧化钙晶体(CaO2·8H2O)较稳定,呈白色,微溶于水,厂泛应用于环境杀菌、消毒。这句话中描叙了过氧化钙的哪些物理性质____(任意答两点),CaO2中O元素的化合价为___价。
(2)气体X的化学式是____;将过氧化钙晶体与溶液分离的方法是____。
(3)贝壳煅烧的产物之一是生石灰(CaO),反应Y发生的是化合反应,反应产物是CaO2·8H2O,请写出该反应的化学方程式____。
【答案】过氧化钙晶体呈白色,微溶于水 -1 CO2 过滤 ![]()
【解析】
(1)根据物质的物理性质分析解答,根据化合物中各元素正负化合价和为零分析解答。
(2)根据高温条件下,碳酸钙分解生成氧化钙和二氧化碳分析解答,过滤可将固体与液体分离。
(3)根据反应物、生成物、反应条件及其质量守恒定律可以书写反应的化学方程式。
(1)过氧化钙晶体(CaO28H2O)较稳定,呈白色,微溶于水,广泛应用于环境杀菌、消毒。这句话中描叙了过氧化钙的物理性质有过氧化钙晶体呈白色,微溶于水;化合物CaO2中各元素正负化合价和为零,Ca元素显+2价,设O元素的化合价为x。则(+2)+2x=0,x=-1,故O元素的化合价为-1价。
(2)碳酸钙分解生成氧化钙和二氧化碳,因此气体X是二氧化碳,化学式为CO2;将过氧化钙晶体与溶液分离的方法是过滤。
(3)氧化钙、水、过氧化氢反应的化学方程式为:![]() 。
。

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目