题目内容
【题目】硫酸的用途极广,常用于生产化肥、冶炼金属等。工业制硫酸的流程:
![]()
(1)①工业制H2SO4可能会引起的环境问题是_______。
②用小木棍蘸少量浓硫酸,放置一会儿后,可观察到蘸有浓硫酸的部位变黑,这是因为浓硫酸具有__________。
(2)某工厂用一定质量分数的稀硫酸处理含Ba(OH)2的残液,变化关系如图。
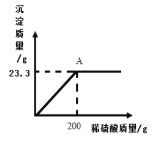
①A点液体的pH_____7(填“大于”、“等于”或“小于”不考虑其它影响);
②所用稀硫酸的溶质质量分数为多少_____?(写出计算过程)
【答案】酸雨 脱水性 等于 4.9%
【解析】
(1)根据二氧化硫与水反应生成亚硫酸和硫酸的脱水性回答;
(2)根据图可知加入200g稀硫酸恰好完全反应,求算所用稀硫酸的溶质质量分数。
解:(1)①工业制H2SO4可能造成二氧化硫遗失到大气中,二氧化硫和水反应转化为亚硫酸或者进一步转化为硫酸,以上物质具有酸性,所以会造成酸雨;
②用小木棍蘸少量浓硫酸,放置一会儿后,可观察到蘸有浓硫酸的部位变黑,这是因为浓硫酸具有脱水性;
(2)根据图可知加入200g稀硫酸恰好完全反应,此时溶液的pH等于7;设所用稀硫酸的溶质质量分数为x,
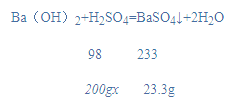
![]()
x=4.9%。

练习册系列答案
相关题目