题目内容
【题目】用科学方法认识和改造物质
只有正确认识了物质,才能合理改造和应用物质.请你运用归纳/演绎、实验、比较/对比等科学方法认识氯化钠。
(1)用归纳演绎法认识氯化钠的性质
已知下列反应:HCl+AgNO3=AgCl+HNO3 MgCl2+2AgNO3=2AgCl↓+Mg(NO3)2
①上述反应属于四种基本反应类型中的 ,运用(填“归纳”或“演绎”) 法得到这组反应发生的原因是 。
②由①中得到的规律可以推测“氯化钠溶液也能跟硝酸银溶液反应”,运用的是(填“归纳”或“演绎”) 法。
(2)用实验法认识氯化钠的性质
①要验证(1)②中“氯化钠溶液也能跟硝酸银溶液反应”的推断,需要进行实验,实验方法是 ,反应的化学方程式是 .
②有实验法认识氯化钠溶液的酸碱性,其实验方法是 .
(3)比较是为了找出事物的相同点,对比是为了找出事物的不同点.
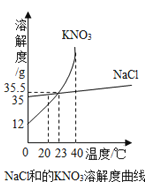
图为氯化钠和硝酸钾溶解度曲线,通过比较/对比可以发现二者的相同点有(选字母编号,下同) ,不同点有 .
A.易溶物质
B.溶解度随温度变化的方向
C.溶解度受温度影响的程度
D.20℃时的饱和溶液溶质质量分数
E.23℃时的溶解度
F.40℃100g饱和溶液降温到20℃析出晶体的质量
(4)用两种重要的实验法﹣﹣“蒸馏法和结晶法”改造物质
从古希腊炼金士到今天的化学工作者,都用了两种重要的实验法﹣﹣蒸馏法和结晶法.证明氯化钠溶于水没有新物质生成,可采用蒸馏法和结晶法中的 ,在生活生产中通过蒸馏法获得物质的一个事例是 ,通过结晶法获得物质的一个事例是 .
【答案】
(1)①复分解反应 归纳 有氯化银沉淀生成 ②演绎
(2)①把氯化钠溶液和硝酸银溶液混合,观察是否有沉淀生成,若有,则证明氯化钠能与硝酸银反应 NaCl+AgNO3=AgCl↓+NaNO3
②用玻璃棒蘸取少量氯化钠溶液滴在干燥的PH试纸上,然后与标准比色卡相比较
(3)ABE CDF
(4)结晶法 用蒸馏法从自来水中获得蒸馏水 用结晶法从海水中获得食盐
【解析】
试题分析:(1)①上述反应由两种化合物相互交换成分生成另外两种化合物,属于四种基本反应类型中的复分解反应;归纳法是根据一系列具体事实概括的一般原理或结论的过程;而演绎法是根据一般原理推理出具体事实的过程.而根据上述2个反应化学反应方程式归纳分析可知,这两个反应的生成物中都有氯化银沉淀生成,因此运用的是归纳法
②由此根据演绎法可推测“氯化钠溶液也能跟硝酸银溶液反应”,因为交换成份后也会有氯化银沉淀生成
(2)①要验证(1)②中“氯化钠溶液也能跟硝酸银溶液反应”的推断,需要进行实验,实验方法是:把氯化钠溶液和硝酸银溶液混合,观察是否有沉淀生成,若有,则证明氯化钠能与硝酸银反应;反应的化学方程式为:NaCl+AgNO3=AgCl↓+NaNO3
②测定溶液的酸碱性,可采PH试纸,其实验方法是:用玻璃棒蘸取少量氯化钠溶液滴在干燥的PH试纸上,然后与标准比色卡相比较
(3)根据氯化钠和硝酸钾溶解度曲线可知,其相同点是:常温下,溶解度都大于10g,故都是易溶于水的物质;溶解度都随温度的升高而增大,故溶解度随温度变化的方向相同;23℃时,两种物质的溶解度曲线交于一点,故两种物质在23℃时的溶解度相同;故二者的相同点有ABE;由于硝酸钾的溶解度受温度的变化影响很大,而氯化钠的溶解度受温度的影响较小,所以其不同点是:溶解度受温度影响的程度不一样;20℃时的饱和溶液溶质质量分数不相同;40℃100g饱和溶液降温到20℃析出晶体的质量不一样,故两者的不同点有:CDF
(4)蒸馏法是利用液体的沸点不同对液体混合物进行分离提纯,而结晶法是溶液中的溶质以晶体形式结晶析出,证明氯化钠溶于水没有新物质生成,即要将氯化钠结晶析出,可采用蒸馏法和结晶法中的结晶法,生活生产中通过蒸馏法获得物质的一个事例:用蒸馏法从自来水中获得蒸馏水;通过结晶法获得物质的一个事例:用结晶法从海水中获得食盐