题目内容
【题目】某化学小组同学做镁条在空气中燃烧实验时,发现生成物中还有少量黑色固体,针对这一现象及相关问题,他们展开了如下探究,请仔细阅读并参与他们的探究之旅。
(探究目的)探究黑色固体时镁与空气中什么物质反应产生的?
(查阅资料)
(1)稀有气体一般不与其它物质反应;
(2)光亮的镁条与水反应,表面会生成白色固体。
(分析猜想)分析空气中各成分,进行猜想:
(1)猜想①是氧气 猜想②是氮气 猜想③是_____________。
(实验一)镁带与氧气的反应
(一)甲同学探究了影响过氧化氢制取氧气速度的某种因素,进行了三次实验并记录了各种收集相同体积氧气所需要的实验如下表:
实验 | 过氧化氢的浓度 | 过氧化氢溶液的质量(g) | 二氧化锰的质量(g) | 收集时间(s) |
1 | 10% | 20 | 1 | 40 |
2 | 15% | 20 | 1 | 20 |
3 | 20% | X | 1 | 12 |
(2)第3次实验中,X的值应为_______________;
(3)实验结论:在相同条件下,___________,过氧化氢分解得越快。
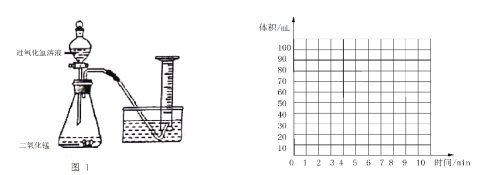
(二)乙同学在量筒中盛满水,倒置与水槽中,通过分液漏斗把20 mL某浓度得过氧化氢溶液加入锥形瓶中,记录量筒中气体得体积(图1)。数据如下表:
时间/min | 1 | 3 | 5 | 7 | 9 | 10 |
量筒读数/mL | 60.0 | 82.0 | 88 | 89.5 | 90 | 90 |
(4)请根据以上过程和实验数据综合分析,最终生成氧气得体积是_________mL;
(5)请在下面坐标中绘制出0~10min生成氧气体积随时间变化得曲线____________;
(三)燃烧镁带,观察现象
将镁带打磨光亮,点燃,伸入盛满氧气的集气瓶中,产生大量白烟,生成白色固体。
实验结论:镁与氧气反应生成白色的氧化镁。
(实验二)镁带与氮气的反应
(一)收集纯净的氮气
(二)燃烧镁带,观察现象
将镁带打磨光亮,点燃,伸入盛有氮气的集气瓶中,瓶内壁附着一层淡黄色的固体。
(6)实验结论:镁与氮气在点燃得的条件下发生化合反应生成淡黄色的氮化镁(Mg3N2),该反应的化学方程式是______________。
(探究结论1)
(7)综上所述,关于镁在空气中燃烧产生黑色固体的猜想是猜想________(填序号)成立。
(探究结论2)
(8)如果用足量的镁替代红磷进行空气组成实验,实验测得氧气的体积分数比实际值_______(填“偏大”或“偏小”)。
(实验回顾)实验室常用红磷燃烧的方法测定空气中氧气含量(图2),由于红磷需要在瓶外点燃再伸入瓶内,常常带来污染以及误差。
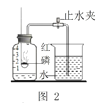
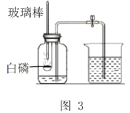
(实验改进)同学们选择了着火点更低的白磷,并对装置图做了改进(图3).主要操作是:再实际容积为180mL的集气瓶里,先装进50 mL的水,再按图连接好仪器,按下热的玻璃棒,白磷立即被点燃。
(9)白磷从燃烧到熄灭冷却的过程中,瓶内水面的变化是_______________;
(10)若实验中无误差,最终集气瓶中水的体积约为_________mL。
(11)集气瓶里预先装进50 mL水的作用,其一是为了加快集气瓶的冷却速度;其二则主要是_____。
(实验与交流)
(12)为了帮助同学们更好地理解空气中氧气含量测定的实验原理,老师利用传感器技术定时测量了实验装置(图4)内的压强、温度和氧气浓度,三条曲线变化趋势如图5所示。Y曲线表示的是________(填“温度”或“氧气的浓度”或“压强”)变化趋势;X曲线中CD段上升的原因是________。
【答案】二氧化碳 20 在相同条件下,过氧化氢溶液的浓度越大则分解得越快 70 见解析(将每个时间的氧气体积减去 20 后再描点,连成一条平滑曲线) 3Mg + N2![]() Mg3N2 ③ 偏大 先下降再上升且比开始时要高 76mL 液封,防止气体因受热膨胀从导管处逸出 见解析 当温度冷却至室温时,打开活塞,烧杯内的水进入集气瓶内,使瓶内气压升高至外界大气压
Mg3N2 ③ 偏大 先下降再上升且比开始时要高 76mL 液封,防止气体因受热膨胀从导管处逸出 见解析 当温度冷却至室温时,打开活塞,烧杯内的水进入集气瓶内,使瓶内气压升高至外界大气压
【解析】
(1)空气中除氧气和氮气外,还有二氧化碳气体,所以猜想③是二氧化碳;
(2)甲同学探究了影响过氧化氢制取氧气速度与过氧化氢浓度的关系,分解控制变量法取用过氧化氢溶液的质量要相等,因此X为20。
(3)由实验数据分析可知,在相同条件下,过氧化氢溶液的浓度越大则分解得越快;
(4)量筒中排开水的体积就是收集到氧气的体积,根据数据分析,向锥形瓶中加入了20mL的过氧化氢溶液,最终量筒中气体的体积为90,说明加入的过氧化氢和生成氧气的体积和为90ml,所以最终生成氧气的体积是70mL;
(5)图略(将每个时间的氧气体积减去 20 后再描点,连成一条平滑曲线)
(6)镁与氮气在点燃条件下发生化合反应生成淡黄色的氮化镁(Mg3N2) 该反应的化学方程式是 3Mg + N2![]() Mg3N2
Mg3N2
(7)综上分析,镁与氧气反应生成白色的固体,镁与氮气反应生成黄色的固体,故关于镁在空气中燃烧产生黑色固体是镁与二氧化碳的反应,即猜想 ③ 成立;
(8) 如果用足量的镁代替红磷进行空气组成实验,因镁会与氮气和二氧化碳发生反应,所以实验测得氧气的体积分数比实际值偏大;
(9)白磷燃烧会使得装置内压强变大,所以瓶内水面会下降,当磷熄灭冷却后因消耗掉瓶内氧气使得装置内压强变小,所以瓶内水面会上升,故从燃烧到熄灭冷却的过程中,瓶内水面的变化是先下降再上升且比开始时要高;
(10).实际容积为180mL 的集气瓶里,先装进 50mL,说明有130mL的空气,氧气约占五分之一,即26mL, 若实验中无误差,最终集气瓶中水的体积为50+26=76mL;
(11).集气瓶里预先装置的 50mL 水的作用,其一是为了加快集气瓶的冷却速度,其二则主要是液封,防止气体因受热膨胀从导管处逸出;
(12)当温度冷却后打开止水夹后水进入集气瓶中,使瓶中的压强基本恢复到原来的值,故X是压强变化线,故Y 曲线表示的是温度的变化趋势,Z曲线一直降低,故是氧气的浓度先 ,X 曲线中 CD 段上升的原因是当温度冷却至室温时,打开活塞,烧杯内的水进入集气瓶内,使瓶内气压升高至外界大气压 。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案【题目】某密闭容器中有X、O2、CO2和 H2O四种物质,在一定条件下充分反应, 测得反应前后各物质的质量如下表。下列说法正确的是 ( )
物 质 | X | O2 | CO2 | H2O |
反应前的质量/g | 1.6 | 8 | 2.2 | 1.8 |
反应后的质量/g | 0 | 1.6 | 待测 | 5.4 |
A. 该反应可能是化合反应 B. 表中“待测”数据为 4.4
C. 反应中的X 与 O2 变化的质量比是 1:4 D. X可能是乙醇
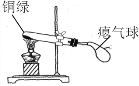
【题目】兴趣小组同学发现实验室一片久置的铜片表面附着有一层绿色固体,查阅资料得知绿色固体是铜绿 [化学式为Cu2(OH)2CO3],甲同学从铜片上刮下一些铜绿进行如下探究,请填写下表中空白:
实验步骤 | 实验现象 | 实验结论 |
| 试管内壁有水雾。 | 铜绿加热产生_________。 |
_________________。 | 铜绿加热后生成氧化铜。 | |
气球胀大。 |
乙同学对气球胀大产生兴趣,于是进行了如下的探究。
(发现问题) 气球为什么会胀大?
(提出猜想) 猜想Ⅰ:试管内的空气受热膨胀使气球胀大;
猜想Ⅱ:铜绿加热产生二氧化碳使气球胀大;
猜想Ⅲ:铜绿加热产生一氧化碳使气球胀大;
猜想Ⅳ:铜绿加热产生一氧化碳和二氧化碳混合气体使气球胀大。
(实验与分析)①熄灭酒精灯后,气球依然胀大没有变瘪,证明猜想___________不成立。
②乙同学用下图装置进行实验:
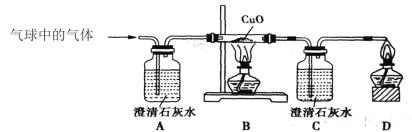
乙同学发现___________________,说明铜绿加热后有CO2产生,产生此现象的化学方程式是________,B处试管内的氧化铜没有变化,说明猜想___________不成立。
(实验结论)猜想Ⅱ成立。
(反思)
(1)加热铜绿反应的化学方程式是__________________。
(2)丙同学认为乙同学如果省略A可达到相同的结论,具体的操作是______________________。