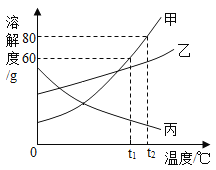
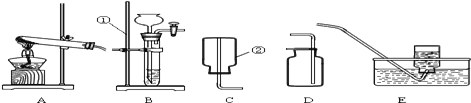
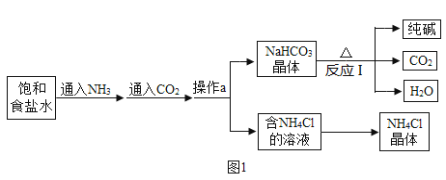
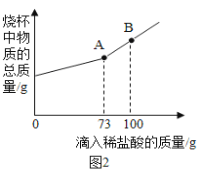
题目内容
【题目】工业上合成清洁燃料乙醇,2CO+4H2 C2H5OH+X。下列说法错误的是
C2H5OH+X。下列说法错误的是
A. 反应前后分子数目变少B. 乙醇中C、H、O元素的质量比为12:3:8
C. X的化学式为H2OD. 将乙醇燃烧,只能生成水和二氧化碳
【答案】D
【解析】
A.由质量守恒定律知:X的化学式为H2O,所以完整的化学方程式为2CO+4H2 C2H5OH+ H2O,反应前分子数为6个,反应后分子数为2个,所以反应后的分子数比反应前少,故A正确;
C2H5OH+ H2O,反应前分子数为6个,反应后分子数为2个,所以反应后的分子数比反应前少,故A正确;
B.乙醇中C、H、O元素的质量比为:(12×2):(1×6):(16×1)=12:3:8,故B正确;
C.X的化学式为H2O,故C正确;
D.将乙醇燃烧,如氧气不足时,可生成一氧化碳、二氧化碳和水,故D错误。故选D。

【题目】碳酸镁水合物是制备镁产品的中间体。
(制取MgCO3·3H2O)工业上从弱碱性卤水(主要成分为MgCl2)中获取MgCO3·3H2O的方法如下:
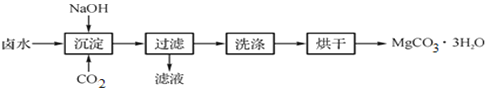
图1 获取MgCO3·3H2O的工艺流程
(1)沉淀过程的化学方程式为:MgCl2+CO2+2NaOH+2H2O![]() MgCO3·3H2O↓+2____。
MgCO3·3H2O↓+2____。
(2)沉淀过程的pH随时间的变化如图2所示,沉淀过程的操作为____(填字母)。
A 向卤水中滴加NaOH溶液,同时通入CO2
B 向NaOH溶液中滴加卤水,同时通入CO2
C 向卤水中通入CO2至饱和,然后滴加NaOH溶液,同时继续通入CO2
D 向NaOH溶液中通入CO2至饱和,然后滴加卤水,同时继续通入CO2
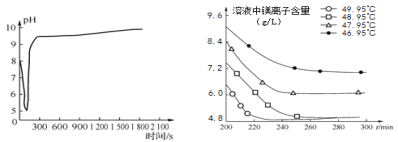
图2 沉淀过程的pH变化 图3 不同温度下溶液中镁离子含量随时间的变化
表1 不同反应温度下的水合碳酸镁
温度(℃) | 产物 |
46.95 | MgCO3·3H2O |
47.95 | MgCO3·3H2O |
48.95 | MgCO3·3H2O |
49.95 | Mg5(OH)2(CO3)4·4H2O |
(3)沉淀过程的溶液中镁离子含量随时间的变化如图3所示,不同温度下所得到沉淀产物如表1所示。则沉淀过程选择的温度为____,理由是____。
(测定MgCO3·3H2O的纯度)
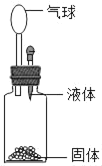
利用下图所示装置(图中夹持仪器略去)进行实验,以确定MgCO3·3H2O的纯度。
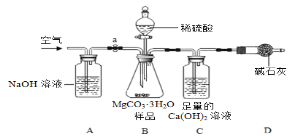
依据实验过程回答下列问题:
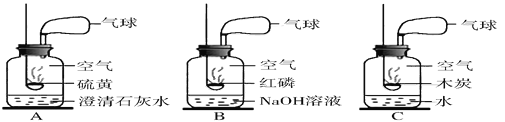
(1)实验过程中需持续____(选填“缓缓”或“迅速”)通入空气,其作用除了可搅拌B、C中的反应物外,还有____。D中碱石灰的作用为____。
(2)下列各项措施中,不能提高测定准确度的是____(填标号)。
A 在加入硫酸之前,应排净装置内的CO2气体
B 为了缩短实验时间,快速滴加硫酸
C 在A~B之间增添盛有浓硫酸的洗气装置
D 在C装置左侧导管末端增添多孔球泡
(3)实验中准确称取15.0 g样品三份,进行三次测定,测得中生成CaCO3沉淀的平均质量为10.0 g。请计算样品中MgCO3·3H2O的纯度________
(4)小明认为应将澄清石灰水换成Ba(OH)2溶液,其理由除了Ba(OH)2溶解度大,浓度大,使CO2被吸收的更完全外,还有____。
(5)若获取MgCO3·3H2O的样品中含有少量Mg5(OH)2(CO3)4·4H2O,则样中MgCO3·3H2O的纯度____(填“偏大”或“不变”或“偏小”)