题目内容
【题目】以高纯度的二氧化锰为原料制备高锰酸钾的主要流程如下
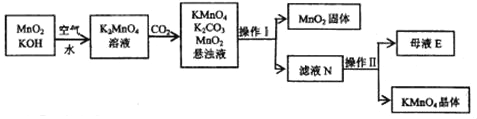
(1)操作I的名称是______,该操作中玻璃棒的作用是______;
(2)操作Ⅱ是根据KMnO4和K2CO3两种物质在溶解性上的差异将两者分离。具体操作步骤为:蒸发浓缩、降温结晶,过滤,洗涤干燥,得KMnO4晶体。则两者中______(填化学式)的溶解度受温度影响变化更大,母液E是高锰酸钾的溶液______(填“饱和”或“不饱和)过程中温度不宜过高,原因是______(用方程式表示)。
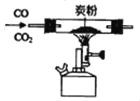
(3)“通CO2”的反应化学方程式为:3K2MnO4+2CO2=2KMnO4+MnO2↓十2K2CO3,该反应中锰元素的转化率(所得高锰酸钾中锰元素与反应物中锰元素的质量百分比)为______(精确到小数点后一位)。
(4)电解法也可以实现由K2MnO4向KMnO4的转化,与“通CO2”相比,其优点是______(填字母,该反应的化学方程式为:2K2MnO4+2H2O![]() 2KMmO4+2KOH十H2↑)。
2KMmO4+2KOH十H2↑)。
a.节约能源 b.锰元素转化率高 c.得到的KOH可以循环利用 d.可以同时获得氢气
【答案】过滤 引流 K2CO3 饱和 2KMnO4![]() K2MnO4+MnO2+O2↑ 66.6% bcd
K2MnO4+MnO2+O2↑ 66.6% bcd
【解析】
(1)操作I是分离难溶性固体与液体的方法,即过滤操作,在过滤操作中玻璃棒的作用是引流;
(2)操作Ⅱ是根据KMnO4和K2CO3两种物质在溶解性上的差异将两者分离;具体操作步骤为:蒸发浓缩、降温结晶,过滤,洗涤干燥,得KMnO4晶体,这说明两者中 碳酸钾的溶解度受温度影响变化更大,得到了高锰酸钾晶体,所以母液E是高锰酸钾的饱和溶液;因为高锰酸钾在加热的条件下分解为锰酸钾、二氧化锰和氧气,所以此过程中温度不宜过高,反应的化学方程式为:2KMnO4![]() K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;
(3)“通CO2”的反应化学方程式为:3K2MnO4+2CO2=2KMnO4+MnO2↓十2K2CO3,该反应中锰元素的转化率(所得高锰酸钾中锰元素与反应物中锰元素的质量百分比)为:![]()
![]() 100%= 66.6%;
100%= 66.6%;
(4)a、此方法需要通电,不能节约能源,故错误;
b、此过程锰元素完全转化为KMnO4中的锰元素,所以锰元素转化率高,故正确;
c、得到的KOH可以循环利用,故正确;
d、可以同时获得氢气,故正确。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案