题目内容
某化学研究小组对当地的石灰石样品进行了研究.称取石灰石样品8g,把40g稀盐酸分四次加入样品中,测得实验数据见下表(假设石灰石样品中杂质不溶于水、不与盐酸反应,二氧化碳不溶解).
求:
(1)第4次剩余固体的质量m;
(2)石灰石样品中CaCO3的质量分数;
(3)生成CO2的总质量是多少?
| 实验序号 | 加入稀盐酸的质量/g | 剩余固体的质量/g |
| 第1次 | 10 | 5.5 |
| 第2次 | 10 | 3 |
| 第3次 | 10 | 1.6 |
| 第4次 | 10 | m |
(1)第4次剩余固体的质量m;
(2)石灰石样品中CaCO3的质量分数;
(3)生成CO2的总质量是多少?
考点:根据化学反应方程式的计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:认真分析表格的数据,前两次加入盐酸,固体质量都是减少了2.5g,而第三次是1.4g,说明第三次盐酸有剩余,碳酸钙已经全部反应;前两次盐酸全部反应,经分析杂质的质量是1.6g,碳酸钙质量就是6.4g.然后根据反应的化学方程式即可求出生成二氧化碳的质量.
解答:解:(1)前三次加入盐酸,样品消耗碳酸钙的质量分别为2.5g、2.5g、1.4g,而每次加的盐酸的量相同,由此可见第三次加入盐酸后,样品中碳酸钙已完全反应.所以m=1.6g
(2)由表中信息可知,剩余的1.6克为杂质的质量,则碳酸钙的质量为8g-1.6g=6.4g;
石灰石样品中CaCO3的质量分数为:
×100%=80%;
(3)设生成二氧化碳的质量为x
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
6.4g x
=
解得:x=2.816g
答:反应结束后生成CO2的质量为2.816g.
故答案为:(1)1.6;
(2)80%;
(3)2.816g.
(2)由表中信息可知,剩余的1.6克为杂质的质量,则碳酸钙的质量为8g-1.6g=6.4g;
石灰石样品中CaCO3的质量分数为:
| 6.4g |
| 8g |
(3)设生成二氧化碳的质量为x
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
6.4g x
| 100 |
| 6.4g |
| 44 |
| x |
解得:x=2.816g
答:反应结束后生成CO2的质量为2.816g.
故答案为:(1)1.6;
(2)80%;
(3)2.816g.
点评:本题是有关化学方程式的计算题,本题属于表格型计算题.此类题目形式多样,主要有两大类:一是根据质量守恒定律,遇到差值求气体;二是减少的质量正好是参加反应的固体质量.本题属于第二种类型.

练习册系列答案
相关题目
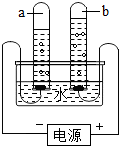 根据所学知识,我们可从“电解水实验”中获得更多的信息和推论.下列说法正确的是( )
根据所学知识,我们可从“电解水实验”中获得更多的信息和推论.下列说法正确的是( )| A、a试管中产生的是氧气 |
| B、水是由氢原子和氧原子直接构成的 |
| C、试管a、b中所得气体的质量比约为2:1 |
| D、试管a、b中所得气体的体积比约为2:1 |
 取一块废旧的铁丝石棉网,将铁丝网剪成几小片,用盐酸除去铁锈,放入锥形瓶中.如图,再向锥形瓶中加入3-4饱和食盐水润湿铁丝,塞紧带导管的单孔塞,导管的一端伸入红色的水中,一段时间后,不可观察到的现象是( )
取一块废旧的铁丝石棉网,将铁丝网剪成几小片,用盐酸除去铁锈,放入锥形瓶中.如图,再向锥形瓶中加入3-4饱和食盐水润湿铁丝,塞紧带导管的单孔塞,导管的一端伸入红色的水中,一段时间后,不可观察到的现象是( )| A、铁丝片生锈且红水上升到玻璃管中 |
| B、红水上升到玻璃管中 |
| C、铁丝片生锈 |
| D、铁丝片消失且红水上升到玻璃管中 |
下列图示的实验操作中,正确的是( )
A、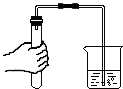 检查气密性 |
B、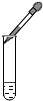 滴加液体 |
C、 稀释浓硫酸 |
D、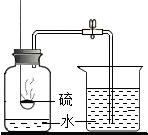 测定空气中氧气的含量 |
