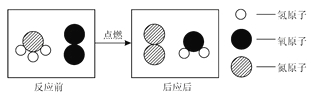
��Ŀ����
����Ŀ��Ϊ�ⶨijһ�����������������������ȡ����һƿ��һ������п������������ʵ��(����ÿ�����)��
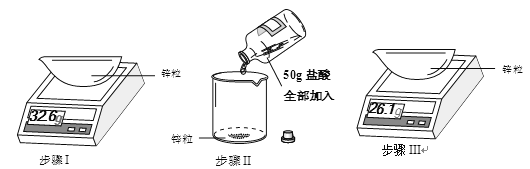
����I����ȡһ������п����
����II����I��������п��ת�����ձ��У�����������ַ�Ӧ��
����III����II�з�Ӧ��Ļ������ˣ���ʣ��п����ɡ���ȴ�ٳ�����
���μӷ�Ӧ��п�������ʵ���Ϊ ��19�� mol��
�������������������������ݻ�ѧ����ʽ��ʽ���㣩 ��20��
���𰸡�(19)0.1��(20)14.6%��
��������
���������(19)���뷴Ӧ��п��������=32.6g-26.1g=6.5g��n(Zn)=6.5g��(65g/mol)=0.1mol��
(20)�������������������Ϊx��
Zn + 2HCl = ZnCl2 + H2��
65 73
6.5g 50g��x
65��6.5g=73��(50g��x) x=14.6%
�𣺸�����������������Ϊ14.6%��

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ