题目内容
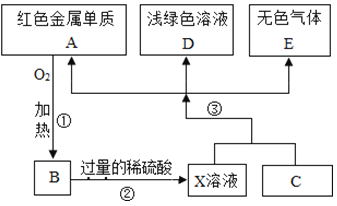
【题目】皮蛋又称松花蛋,因其风味独特,深受人们喜爱。某兴趣小组在市场上获得了少许腌制皮蛋的原料。拿到实验室进行实验。将该固体混合物放于烧杯中,缓慢加入足量的蒸馏水,充分溶解后过滤,得到白色沉淀A和无色澄清滤液B。
(提出问题)(1)白色沉淀A是什么?
(2)无色滤液B中的溶质有哪些?
(查阅资料)腌制皮蛋的原料配方是少量NaCl、CaO和Na2CO3过量的固体混合物。
(理论推理)(1)白色沉淀A是CaCO3,请写出生成该沉淀的化学方程式______。
(2)滤液B中含有Na2CO3、NaOH、NaCl三种溶质。
(实验验证)为证明滤液B中存在的三种溶质,同学们进行了如下实验。
步骤 | 实验操作 | 实验现象 | 实验结论 |
I | 取少量滤液B于试管中,加入过量的Ba(NO3)2溶液,过滤 | ______ | 滤液B中含有Na2CO3、NaOH、NaCl |
II | 取少量步骤I中所得滤液于试管中,加入酚酞溶液 | ______ | |
III | 另取少量步骤I中所得滤液于试管中,先加入足量的稀硫酸,再加入______溶液 | 产生白色沉淀 |
(拓展提升)
(1)向步骤I中加入过量Ba(NO3)2溶液的目的是______。
(2)小妮同学认为若将步骤I中的Ba(NO3)2溶液换为BaCl2溶液,进行以上实验,最终也能证明滤液B中存在的三种溶质。你认为是否合理______(填“合理”或“不合理”)。
(3)小轩同学认为向滤液B中先加入酚酞溶液,后加入过量的Ba(NO3)2溶液,也能得出滤液B的溶质中含有Na2CO3和NaOH的结论,你是否同意他的观点并说明理由______。
【答案】![]() 产生白色沉淀 溶液由无色变成红色 硝酸银 验证并除去溶液中的Na2CO3 不合理 同意;加入Ba(NO3)2溶液后,若产生白色沉淀且溶液红色不褪去,就证明溶质中含有Na2CO3和NaOH
产生白色沉淀 溶液由无色变成红色 硝酸银 验证并除去溶液中的Na2CO3 不合理 同意;加入Ba(NO3)2溶液后,若产生白色沉淀且溶液红色不褪去,就证明溶质中含有Na2CO3和NaOH
【解析】
理论推理:原料配方是少量NaCl、CaO和Na2CO3,将固体溶于水,氧化钙与水反应生成氢氧化钙,氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,白色沉淀A是![]() ,生成该沉淀的化学方程式为:
,生成该沉淀的化学方程式为:![]() ;
;
实验验证:
Ⅰ硝酸钡与碳酸钠会产生碳酸钡白色沉淀,取少量滤液B于试管中,加入过量的Ba(NO3)2溶液,过滤,产生白色沉淀,说明滤液B中含有Na2CO3;
Ⅱ、Ⅲ实验结论为滤液B中含有NaOH、NaCl
Ⅱ取少量步骤 I中所得滤液于试管中,加入酚酞溶液,因为结论为滤液中含有氢氧化钠,故实验现象为:溶液由无色变成红色;
Ⅲ另取少量步骤 I中所得滤液于试管中,先加入足量的稀硫酸,可以除去过量的硝酸钡,因为稀硫酸与硝酸钡反应生成硫酸钡沉淀和硝酸,根据氯离子的鉴定可知,再加入硝酸银溶液,产生白色沉淀,说明滤液B中含有NaCl;
拓展提升:
(1)向步骤I中加入过量Ba(NO3)2溶液的目的是验证并除去溶液中的Na2CO3;
(2)加入BaCl2溶液会引入氯离子,无法证明氯化钠的存在,故不合理;
(3)向滤液B中先加入酚酞溶液,溶液由无色变成红色,溶液呈碱性,后加入过量的Ba(NO3)2溶液,产生白色沉淀,且红色未褪去,说明滤液B中含有Na2CO3、NaOH;故也能得出滤液B的溶质中含有Na2CO3和NaOH的结论

【题目】我国高铁、航空航天、手机制造等都已经跻身世界一流水平,根据下列材料的应用回答问题。
应用 | “复兴号”高铁车轮 | “鲲龙”水陆两栖飞机零部件 | 华为折叠手机屏幕 |
用到的材料 | 高速钢 | 钛合金、铝合金 | 聚酰亚胺塑料 |
(1)上述材料中属于有机合成材料的是_____。
(2)飞机外壳用钛合金、铝合金的优点是_____ 。
(3)在对高铁钢轨中的缝隙进行焊接时,常用铝和氧化铁在高温条件下反应生成熔融状态下的铁和另一种氧化物。该反应的化学方程式为_____ 。