题目内容
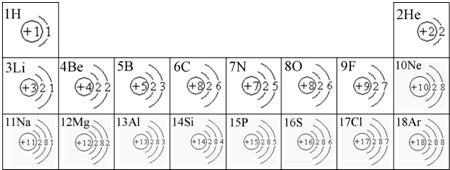
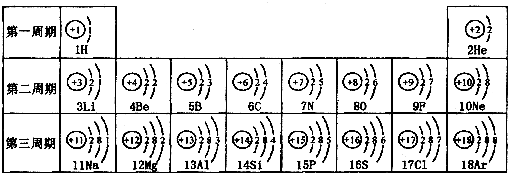
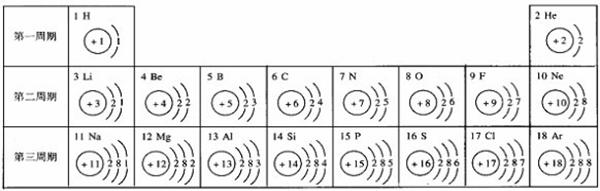
下图是原子序数前18号元素的原子结构示意图按周期表的排列而成的图示:
(1)9号元素F属于 (选填“金属”或“非金属”)元素,形成简单离子的离子符号_ _;
(2)写出12号元素与17号元素形成化合物的化学式: ;
(3)从上图中我可以探究出以下规律:核外电子数= =原子序数= .
(4)研究表明:第二周期从3号~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子的半径逐渐减小.我分析第三周期从11号~17号元素原子半径变化规律是: .
(5)据图,我得出了“同一周期元素的原子电子层数相同,核电荷数逐渐增大”的规律,此外,我还探究出了一些规律: .
| 第一周期 | 1H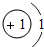 |
2He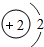 | ||||||
| 第二周期 | 3Li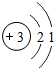 |
4Be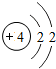 |
5B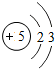 |
6C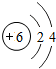 |
7N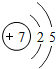 |
8O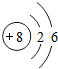 |
9F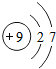 |
10Ne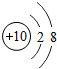 |
| 第三周期 | 11Na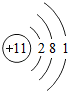 |
12Mg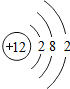 |
13Al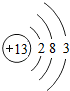 |
14Si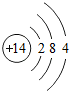 |
15P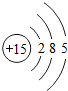 |
16S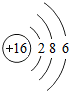 |
17Cl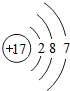 |
18Ar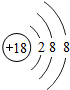 |
(2)写出12号元素与17号元素形成化合物的化学式:
(3)从上图中我可以探究出以下规律:核外电子数=
(4)研究表明:第二周期从3号~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子的半径逐渐减小.我分析第三周期从11号~17号元素原子半径变化规律是:
(5)据图,我得出了“同一周期元素的原子电子层数相同,核电荷数逐渐增大”的规律,此外,我还探究出了一些规律:
分析:(1)由元素周期表及原子结构示意图可知,9号元素F最外层电子数,符合非金属原子的最外层电子数特点;根据最外层电子数,可知得电子情况,也就可知带电荷数,可书写离子符号;
(2)先推测12号元素与17号元素分别为镁元素和氯元素,再根据它们的化合价数值,利用化合价数值交叉法书写化学式;
(3)利用归纳总结的方法,归纳出核外电子数=质子数=原子序数=核电荷数进行解答;
(4)根据第二周期中原子的半径逐渐减小可推知第三周期从11号~17号元素原子半径变化规律是原子电子层数相同,核电荷数逐渐增大,所以其原子半径也是逐渐减小进行解答;
(5)根据图可知同一族,最外层电子数相同进行解答.
(2)先推测12号元素与17号元素分别为镁元素和氯元素,再根据它们的化合价数值,利用化合价数值交叉法书写化学式;
(3)利用归纳总结的方法,归纳出核外电子数=质子数=原子序数=核电荷数进行解答;
(4)根据第二周期中原子的半径逐渐减小可推知第三周期从11号~17号元素原子半径变化规律是原子电子层数相同,核电荷数逐渐增大,所以其原子半径也是逐渐减小进行解答;
(5)根据图可知同一族,最外层电子数相同进行解答.
解答:解:(1)由元素周期表及原子结构示意图可知,9号元素F最外层电子数为7,符合非金属原子的最外层电子数特点,故9号元素F属于非金属元素;根据最外层电子数,可知得1个电子达稳定,也就可知带1个负电荷数,故可书写离子符号为F-;
(2)12号元素与17号元素分别为镁元素和氯元素,已知镁元素的化合价为+2价,氯元素与金属形成化合物时,其化合价为-1价,利用化合价数值交叉法书写化学式,故其化学式为MgCl2;
(3)利用归纳总结的方法,归纳出核外电子数=质子数=原子序数=核电荷数;
(4)第二周期中原子的半径逐渐减小可推知第三周期从11号~17号元素原子半径变化规律是原子电子层数相同,核电荷数逐渐增大,所以其原子半径也是逐渐减小;
(5)由图可知同一族,最外层电子数相同.
故答案为:(1)非金属元素、F-;(2)MgCl2;
(3)质子数;核电荷数;
(4)原子电子层数相同,核电荷数逐渐增大,所以其原子半径也是逐渐减小;
(5)同一族,最外层电子数相同.
(2)12号元素与17号元素分别为镁元素和氯元素,已知镁元素的化合价为+2价,氯元素与金属形成化合物时,其化合价为-1价,利用化合价数值交叉法书写化学式,故其化学式为MgCl2;
(3)利用归纳总结的方法,归纳出核外电子数=质子数=原子序数=核电荷数;
(4)第二周期中原子的半径逐渐减小可推知第三周期从11号~17号元素原子半径变化规律是原子电子层数相同,核电荷数逐渐增大,所以其原子半径也是逐渐减小;
(5)由图可知同一族,最外层电子数相同.
故答案为:(1)非金属元素、F-;(2)MgCl2;
(3)质子数;核电荷数;
(4)原子电子层数相同,核电荷数逐渐增大,所以其原子半径也是逐渐减小;
(5)同一族,最外层电子数相同.
点评:了解元素周期表的特点及其应用;了解元素的简单分类;掌握物质化学式的书写方法及意义.

练习册系列答案
相关题目
下图是原子序数前18号元素的原子结构示意图按周期表的排列而成的图示:
| 第一周期 | 1H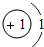 | 2He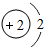 | ||||||
| 第二周期 | 3Li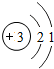 | 4Be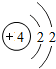 | 5B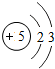 | 6C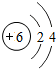 | 7N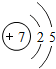 | 8O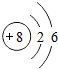 | 9F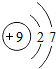 | 10Ne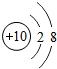 |
| 第三周期 | 11Na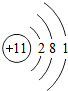 | 12Mg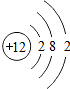 | 13Al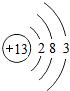 | 14Si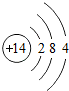 | 15P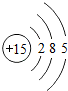 | 16S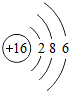 | 17Cl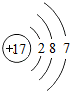 | 18Ar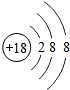 |
(2)写出12号元素与17号元素形成化合物的化学式:________;
(3)从上图中我可以探究出以下规律:核外电子数=________=原子序数=________.
(4)研究表明:第二周期从3号~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子的半径逐渐减小.我分析第三周期从11号~17号元素原子半径变化规律是:________.
(5)据图,我得出了“同一周期元素的原子电子层数相同,核电荷数逐渐增大”的规律,此外,我还探究出了一些规律:________.
 (1)9号元素F属于 (选填“金属”或“非金属”)元素,形成简单离子的离子符号_ _;
(1)9号元素F属于 (选填“金属”或“非金属”)元素,形成简单离子的离子符号_ _;