题目内容
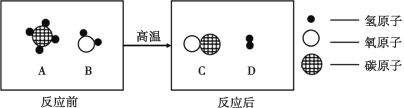
【题目】某市发现一大型铁矿,主体为磁铁矿。冶炼磁铁矿的反应为:Fe3O4 + 4CO 高温3Fe + 4CO2。用100t含Fe3O480%的磁铁矿石,理论上冶炼含杂质4%的生铁多少吨?(答案保留一位小数)
【答案】60.3t
【解析】
试题分析:根据化学反应方程式:Fe3O4 + 4CO 高温 3Fe +4CO2中Fe3O4与Fe的质量关系,可求出铁的质量,进一步可计算出生铁的质量
解:设可炼出的铁的质量为x
100t含Fe3O480%的磁铁矿石中氧化铁的质量=100t×80%=80t
Fe3O4 + 4CO![]() 3Fe +4CO2
3Fe +4CO2
232 168
80t x
232:168=80t:x
x ≈58t
所以生铁的质量=58t÷(1-4%)=60.3t
答:略

练习册系列答案
相关题目
【题目】对下列事实解释不正确的是
选项 | 事 实 | 解 释 |
A | 体温计中的水银(汞)热胀冷缩 | 原子的体积热胀冷缩 |
B | 一滴水中大约有1.67×1021个水分子 | 分子很小 |
C | 敞口容器中的酒精逐渐减少 | 分子在不断运动 |
D | 炎热的夏天自行车车胎容易爆裂 | 夏天温度高,分子间间隔变大 |