题目内容
【题目】实验室可用图所示装置,进行CO和CO2混合气体的分离和干燥。已知a为止水夹,b为分液漏斗丙的活塞。试回答:
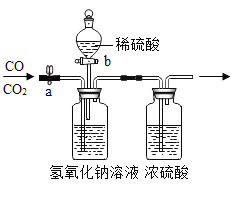
(1)第一步应先分离出___,分离时应先关闭___,打开___,发生反应的化学方程式是____。
(2)第二步分离出____时,先关闭_____,打开_____,发生反应的化学方程式为______。
【答案】CO b a 2NaOH+CO2=Na2CO3+H2O CO2 a b Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
【解析】
(1)二氧化碳与氢氧化钠反应生成碳酸钠和水,一氧化碳和氢氧化钠不反应,可知通入混合气体,先分离得到的是CO气体,应关闭b打开a,用氢氧化钠吸收二氧化碳,化学反应为2NaOH+CO2=Na2CO3+H2O;
(2)后得到CO2气体,关闭a防止再进入CO,打开b让硫酸和碳酸钠反应生成二氧化碳,所以应关闭a打开b,碳酸钠与硫酸反应生成二氧化碳,化学反应为Na2CO3+H2SO4=Na2SO4+CO2↑+H2O。

【题目】下面是某化学兴趣小组的同学对氢氧化钠部分性质的探究过程:
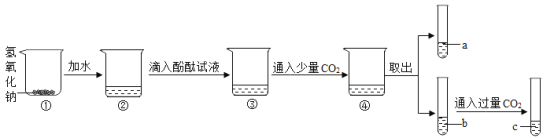
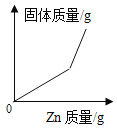
(1)用手触摸②的烧杯外壁,感觉发烫,这是由于氢氧化钠固体溶于水时会_______(填“吸热”或“放热”),③中的溶液显_______色.
(2)从③到④溶液的颜色变化不明显,说明④中的溶液呈______性(填“酸”或“碱”).
(3)c溶液和a溶液对比,c溶液颜色更浅.
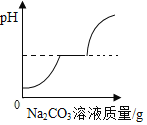
(提出问题)为什么继续通入过量的二氧化碳气体溶液颜色会更浅?
(查阅资料)(1)Na2CO3+CO2+H2O==2NaHCO3 (2)Ca(NO3)2溶液与NaHCO3溶液不反应
(设计实验)
实验操作 | 实验现象 | 实验结论 |
取少量c溶液滴入稀盐酸 | ____ | 溶液中含较多的CO32﹣或HCO3﹣ |
另取少量c溶液滴入硝酸钙溶液 | 无明显现象 | 溶液中没有大量的____离子 |
(实验结论)根据甲、乙两个实验得出的结论,写出甲实验中发生反应的化学方程式:_____________________________.
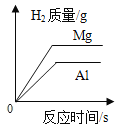
(实验反思)同种反应物在不同的条件下发生化学反应时,可能得到不同的产物.如:碳在氧气中燃烧可以生成________或________.
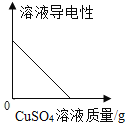
(实验拓展)106g10% Na2CO3溶液与Ca(NO3)2完全反应生成沉淀 ______g
【题目】推理是学习化学的一种重要方法,但不合理的推理会得出错误的结论.请对下列错误观点用化学式或化学方程式写出相应的否定例证.
错误观点 | 否定例证 | |
① | 有单质和化合物生成的反应一定是置换反应 | 举例:CuO+CO |
② | 均一、稳定的液体一定是溶液 | __ |
③ | 含有碳元素的化合物一定是有机物 | __ |
④ | 生成盐和水的反应一定是中和反应 | __ |
【题目】根据如表回答问题.
温度(℃) | 20 | 40 | 50 | 60 | 80 | |
溶解度 (g/100g水) | NaCl | 36.0 | 36.6 | 37.0 | 37.3 | 38.4 |
NH4Cl | 37.2 | 45.8 | 50.4 | 55.2 | 65.6 | |
KNO3 | 31.6 | 63.9 | 85.5 | 110 | 169 | |
①20℃时,溶解度最大的物质是
②50℃时,100g水中最多溶解NaCl g
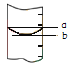
③量筒的局部示意见图,量取水时应沿 视线(选填“a”或“b”)进行读数, 视线(选填“a”或“b”)对应的读数较大.
④A是80℃含有120g水的KNO3溶液,经过如下操作,得到102gKNO3固体.
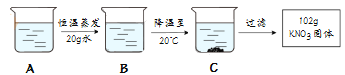
I.A溶液为 (选填“饱和”或“不饱和”)溶液
II.对以上过程的分析,正确的是 (选填编号)
a.A到B的过程中,溶质质量没有改变
b.B中溶质与溶剂的质量比为169:100
c.开始析出KNO3固体的温度在60℃至80℃之间
d.A溶液的质量等于222g.