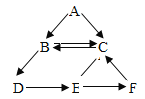
��Ŀ����
����Ŀ��Ԫ�����ڱ���ѧϰ���о���ѧ����Ҫ���ߣ�������Ԫ�����ڱ���һ���֡���ϸ�Ķ����ش����⡣
��1����ͬ��Ԫ����ʵ�������__________������ţ���
A ��������ͬ
B ��������ͬ
C ��������ͬ
D ���ԭ��������ͬ
��2��11��Ԫ������__________�����������������ǽ�������Ԫ�أ�11�ź�9����ʾ����Ԫ���γɻ�����Ļ�ѧʽΪ___________��������������__________������ԭ�����������������������������ɵġ�
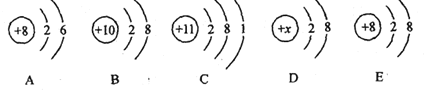
��3��ԭ�ӵõ���ʧȥ���Ӻ��γ����ӡ�ij���ӵĽṹʾ��ͼΪ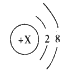
�ٵ�X=__________ʱ����������ԭ�ӣ�
�ڵ�X=8ʱ����������__________������ԭ�����������������������������������Ϊ___________��
�۵�X>10ʱ����������___________��������������ʧ���������γɵģ�
��4�������ܽ�ͷ�����ѧ�û�ѧ��һ��;������д�������㷢�ֵ�һ�����ɣ�________
���𰸡�A ���� NaF ���� 10 ������ O2- ʧ ͬһ���ڣ��������ң�Ԫ�ص�ԭ�Ӻ�����������С�������ε���
��������
��1��Ԫ���Ǿ�����ͬ��������һ��ԭ�ӵ��ܳƣ���ͬ��Ԫ����ʵ���������������ͬ����ѡA��
��2��11��Ԫ������Ԫ�أ����ڽ���Ԫ�أ�9��Ԫ���Ƿ�Ԫ�أ����ݻ������и�Ԫ�ػ��ϼ۵Ĵ�����Ϊ�㣬11��Ԫ�غ�9��Ԫ������Ԫ����ɻ�����Ļ�ѧʽΪNaF��NaF�������ӹ��ɵġ�
��3����ԭ����������=������������ʵ�X=2+8=10ʱ����������ԭ�ӣ��ڵ�X=8ʱ����������������8�������������10���������������ӣ�����2����λ�ĸ���ɣ��������ӣ������ΪO2-���۵�X>10ʱ���������������ӣ���ԭ��ʧ�����γɵġ�
��4�������ܽ�ͷ�����ѧ�û�ѧ��һ��;����Ԫ�����ڱ��е�һ�����ɣ�ͬһ���ڣ��������ң�Ԫ�ص�ԭ�Ӻ�����������С�������ε�����

 ���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д�
���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д� ����ѵ��ϵ�д�
����ѵ��ϵ�д� ��ĩ�����ϵ�д�
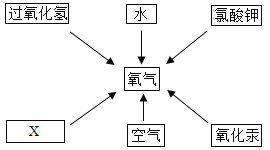
��ĩ�����ϵ�д�����Ŀ����1���û�ѧ������գ�
��2����������________
��2����������____
��2�����������_________
����Ȼ������Ҫ�ɷ� _________
��2���������������Ư�������ܻ���,����������ײ���һ���ж�����X����Ӧԭ��Ϊ:![]() ,��X�Ļ�ѧʽΪ_________________
,��X�Ļ�ѧʽΪ_________________
��3����һ���ܱ����������������ʣ���һ�������³�ַ�Ӧ��һ��ʱ���÷�Ӧǰ������ʵ��������£�
���� | M | N | Q | P |
��Ӧǰ��������g�� | 18 | 1 | 2 | 32 |
��Ӧ���������g�� | ���� | 26 | 2 | 12 |
�ٴ���ֵΪ_________�ڸñ仯�Ļ�����Ӧ������_________________
����Ŀ����֪M��N�ֱ���ϡ���ᡢ����������Һ�е�һ�֡�ij��ѧ��ȤС��ͬѧ��һ������M�в��ϵμ�N�����ⶨ������Һ��pHֵ����ͼ��ʾ��
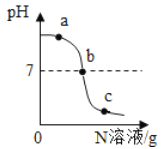
(1)M��__________ ,�÷�Ӧ�Ļ�ѧ����ʽ_________��
(2)��Ӧ�����У���ʦȡa��b��c������Ӧ�����Һ������˳�����ͬѧ�Dz��ⶨ��Һ��pHֵ��������������������Һ����̽����
С����С��ֱ�ȡ����һ����Һ����ʵ�飺
С������ȡ��Һ�м���________________��Һ���۲쵽����ɫ�������ɡ�
���ۣ���a����Һ��
С����������һ����Һ�еμӷ�̪��Һ���۲쵽________________________��
���ۣ���b����c����Һ��
Ϊ��һ��ȷ������Һ�ɷ֣�С������Ʋ��������ʵ�飺
ʵ�鲽�� | ʵ������ | ���� |
1 | ________ | Ϊc����Һ������֪��Һ�е�������__________(��д���ӷ���) |
ʣ��һ��Ϊb����Һ��ͨ��ʵ�飬ͬѧ��֪������Ӧ������pH�ı仯���ò�ͬ����ȷ����Һ�ɷ֡�