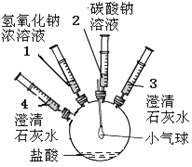
题目内容
【题目】某实验小组的同学要探究酸碱盐中碳酸钠的化学性质,设计了如下实验装置及方案:
实验装置 | 实验步骤及操作 | 实验现象 |
| ①将注射器2中的溶液推入盛有稀盐酸的瓶中,至不再有气泡产生。 | 气球变瘪 |
②将注射器3稍稍向外拉 | 澄清石灰水变浑浊 | |
③将注射器1中的溶液推入瓶中 | 气球鼓起 | |
④将注射器4中的溶液推入瓶中 | 溶液变浑浊 |
(1)步骤①中气球变瘪的原因___________________________________________。
(2)步骤③中气球鼓起的原因____________________________________________。
(3)步骤④中发生反应的化学方程式______________________________________。
【答案】 碳酸钠与稀盐酸反应生成CO2,内部压强大于大气压 氢氧化钠溶液吸收了CO2,内部压强小于大气压 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
【解析】(1)步骤①中气球变瘪的原因:将注射器2中的溶液推入盛有稀盐酸的瓶中,碳酸钠与稀盐酸反应生成CO2,内部压强大于大气压,把瓶中的气球压扁
(2)③将注射器1中的NaOH溶液推入瓶中,NaOH溶液能与二氧化碳发生反应:2NaOH + CO2== Na2CO3+ H2O,这样二氧化碳被消耗,瓶内压强减小,气球鼓起,
(4)步骤④将注射器4中的澄清石灰水推入瓶中,与步骤④生成的Na2CO3反应,所以步骤④中发生反应的化学方程式Ca(OH)2+Na2CO3=CaCO3↓+2NaOH

【题目】某课外兴趣小组为探究铁合金中铁的质量分数,先后进行了四次实验(杂质不与稀硫酸反应,也不溶于水),实验数据如下表:
第一次 | 第二次 | 第三次 | 第四次 | |
所取合金的质量/g | 10 | 10 | 20 | 30 |
所加稀硫酸的质量/g | 100 | 120 | 80 | X |
反应后烧杯内的剩余物/g | 109.8 | 129.8 | 99.8 | Y |
请你认真分析数据,回答下列问题:
(1)上表第四次实验中合金里的铁恰好与稀硫酸完全反应,则其中X= g,Y= g
(2)该铁合金中铁的质量分数是多少?
(3)计算第四次实验反应后溶液中溶质的质量分数?(结果保留至0.1%)。
(2、3小题写出计算步骤。)