题目内容
【题目】某课外兴趣小组为探究铁合金中铁的质量分数,先后进行了四次实验(杂质不与稀硫酸反应,也不溶于水),实验数据如下表:
第一次 | 第二次 | 第三次 | 第四次 | |
所取合金的质量/g | 10 | 10 | 20 | 30 |
所加稀硫酸的质量/g | 100 | 120 | 80 | X |
反应后烧杯内的剩余物/g | 109.8 | 129.8 | 99.8 | Y |
请你认真分析数据,回答下列问题:
(1)上表第四次实验中合金里的铁恰好与稀硫酸完全反应,则其中X= g,Y= g
(2)该铁合金中铁的质量分数是多少?
(3)计算第四次实验反应后溶液中溶质的质量分数?(结果保留至0.1%)。
(2、3小题写出计算步骤。)
【答案】(1)240;269.4;(2)56%;(3)17.8%
【解析】(1)由表格数据,对比第一次和第二次实验当增加稀硫酸的质量后,生成的氢气不变,说明10g合金已经完全反应;再对比第一次和第三次实验数据,当加入的金属的质量增加,稀硫酸的质量减少,生成氢气的质量仍为0.2g,说明第三次实验中的稀硫酸完全反应。综合考虑可知10g合金和80g稀硫酸恰好完全反应,生成氢气0.2g。当加入的合金的质量是30g时,需要稀硫酸的质量应为240g,生成氢气的质量为0.6g,即Y=30g+240g-0.6g= 269.4g;(2)利用化学方程式,根据氢气和铁的质量比即可计算出合金中铁的质量。
设合金中铁的质量为x;
Fe+ H2SO4 == FeSO4 + H2↑
56 2
X 0.2g
![]() x=5.6g
x=5.6g
该铁合金中铁的质量分数=![]() 56%
56%
(3)设第四次实验反应生成的硫酸亚铁的质量为y;
Fe+ H2SO4 == FeSO4 + H2↑
152 2
y 0.6g
![]() y=45.6g
y=45.6g
反应后溶液的质量=30g![]() 56%+240g-0.6g=256.2g
56%+240g-0.6g=256.2g
溶液中溶质的质量分数=![]() 17.8%
17.8%
答:该铁合金中铁的质量分数是56%;第四次实验反应后溶液中溶质的质量分数17.8%。

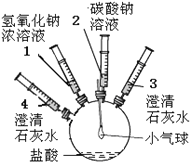
【题目】某实验小组的同学要探究酸碱盐中碳酸钠的化学性质,设计了如下实验装置及方案:
实验装置 | 实验步骤及操作 | 实验现象 |
| ①将注射器2中的溶液推入盛有稀盐酸的瓶中,至不再有气泡产生。 | 气球变瘪 |
②将注射器3稍稍向外拉 | 澄清石灰水变浑浊 | |
③将注射器1中的溶液推入瓶中 | 气球鼓起 | |
④将注射器4中的溶液推入瓶中 | 溶液变浑浊 |
(1)步骤①中气球变瘪的原因___________________________________________。
(2)步骤③中气球鼓起的原因____________________________________________。
(3)步骤④中发生反应的化学方程式______________________________________。
【题目】金属在日常生活、工农业生产和科学研究方面应用广泛。
(1)某实验小组为了探究锌与硫酸反应快慢的影响因素,进行了如下实验。
实验编号 | 硫酸的质量分数 (均取20 mL) | 锌的形状 (均取1g) | 氢气的体积(mL) (均收集3分钟) |
① | 20% | 锌粒 | 31.7 |
② | 20% | 锌片 | 50.9 |
③ | 30% | 锌粒 | 61.7 |
④ | 30% | 锌片 | 79.9 |
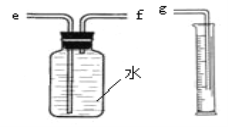
①用如图装置收集并测量氢气的体积,其中量筒作用是_____________________,氢气应从_____(填e或f或g)管通入。
②要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是___________。
③下表是小兵第①组实验的详细数据。
时段(均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
H2的体积 | 3.1mL | 16.7mL | 11.9mL | 9.6mL | 7.6mL | 6.0mL |
请描述锌与硫酸反应的快慢的变化_________________________________________。
解释原因_________________________________________________________。
(2)保险粉(化学式 Na2S2O4)在工农业生产中有广泛的用途,Na2S2O4 在碱性溶液中稳定,在中性和酸性溶液中极不稳定;在 NaCl 存在下,Na2S2O4 在水中溶解度显著下降。Na2S2O4 制备流程如下:
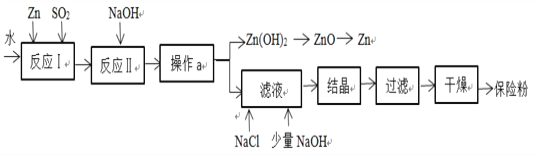
①已知反应Ⅰ的原理为:Zn + 2SO2 == ZnS2O4,反应Ⅱ为复分解反应,反应Ⅱ的化学方程式为______________________________________________。
②操作a的名称为_______________________。
③滤液中含有 Na2S2O4,为使 Na2S2O4 结晶析出还需要加入少量 NaOH 的原因是__________________________, 加入NaCl的原因是_______________________。
④198gZn(OH)2理论上能得到Zn的质量为_____________。