题目内容
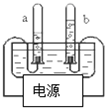 用如图所示的装置进行电解水实验,
用如图所示的装置进行电解水实验,(1)收集到a、b两试管的气体,其体积比为
2:1
2:1
,电解水的化学方程式2H2O
2H2↑+O2↑
| ||
2H2O
2H2↑+O2↑
.
| ||
(2)在图上画出所用电源的正、负极.
(3)检验b试管中气体的方法是
方法是用带火星的木条检验看是否复燃.
方法是用带火星的木条检验看是否复燃.
(4)有两瓶无标签的无色液体,分别是水和酒精,可用一种固体试剂简单地区分这两种液体,其过程用化学方程式表示为
CuSO4+5H2O=CuSO4?5H2O
CuSO4+5H2O=CuSO4?5H2O
(5)电解54克水可得氢气分子多少个?(列式计算)
分析:(1)根据电解水的原理及现象解答
(2)根据氢二氧一,正氧负氢解答
(3)根据氧气能使带火星木条复燃解答.
(4)根据无水硫酸铜遇水变蓝解答
(5)根据水的质量可求出氢气的物质的量,从而求出氢分子的个数.
(2)根据氢二氧一,正氧负氢解答
(3)根据氧气能使带火星木条复燃解答.
(4)根据无水硫酸铜遇水变蓝解答
(5)根据水的质量可求出氢气的物质的量,从而求出氢分子的个数.
解答:解:(1)a试管中收到到的气体体积多,为氢气,b试管中收到的是氧气,其体积比为 2:1,电解水生成氢气和氧气,化学方程式 2H2O
2H2↑+O2↑.
(2)a试管中收到到的气体体积多,为氢气,相连的为电源的负极,b试管中收到的是氧气,和b相连的是电源的正极.
(3)b试管中产生的气体是氧气,能使带火星木条复燃,所以检验方法是用带火星的木条看其是否复燃.
(4)无水硫酸铜遇水变蓝,化学方程式为CuSO4+5H2O=CuSO4?5H2O
(5)解:设电解54g水可得氢气的物质的量为x
2H2O
2H2↑+O2↑
2 2
x
=
x=3mol
所以电解生成的氢分子的个数为3mol×6.02×1023个/mol=1.806×1024
故答案为:(1)2:1,2H2O
2H2↑+O2↑
(2)a试管相连的是负极,b试管相连的是正极.
(3)方法是用带火星的木条检验看是否复燃.
(4)CuSO4+5H2O=CuSO4?5H2O
(5)1.806×1024
| ||
(2)a试管中收到到的气体体积多,为氢气,相连的为电源的负极,b试管中收到的是氧气,和b相连的是电源的正极.
(3)b试管中产生的气体是氧气,能使带火星木条复燃,所以检验方法是用带火星的木条看其是否复燃.
(4)无水硫酸铜遇水变蓝,化学方程式为CuSO4+5H2O=CuSO4?5H2O
(5)解:设电解54g水可得氢气的物质的量为x
2H2O
| ||
2 2
| 54g |
| 36g/mol |
| 2 |
| 3mol |
| 2 |
| x |
所以电解生成的氢分子的个数为3mol×6.02×1023个/mol=1.806×1024
故答案为:(1)2:1,2H2O
| ||
(2)a试管相连的是负极,b试管相连的是正极.
(3)方法是用带火星的木条检验看是否复燃.
(4)CuSO4+5H2O=CuSO4?5H2O
(5)1.806×1024
点评:明确电解水原理、现象、生成物的检验方法及根据化学方程式计算是解答本题关健.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 30、陈纬同学将浑浊的河水样品倒入烧杯中,先加入明矾粉末搅拌溶解,静置一会后,用如图所示的装置进行过滤,请问:
30、陈纬同学将浑浊的河水样品倒入烧杯中,先加入明矾粉末搅拌溶解,静置一会后,用如图所示的装置进行过滤,请问:

 陈纬同学将浑浊的湖水样品倒入烧杯中,先加明矾粉末搅拌溶解,静置一会后,用如图所示的装置进行过滤,请问:
陈纬同学将浑浊的湖水样品倒入烧杯中,先加明矾粉末搅拌溶解,静置一会后,用如图所示的装置进行过滤,请问: