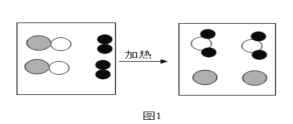
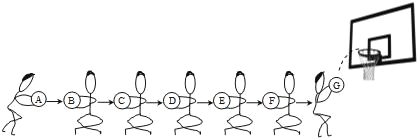
��Ŀ����
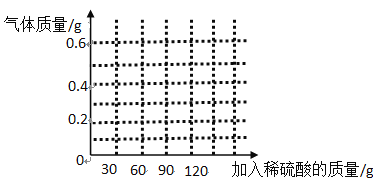
����Ŀ����ѧʵ��С��ͬѧΪ�о�ij�����������ƻ�����ʴ�ij̶ȣ���12.8g��Ƭ��Ʒ��һ��Ũ�ȵ�ϡ���������ͼʵ��װ���г�ַ�Ӧ��������Һ������ƿ�У���Һ��ƣ������ݲ������ձ��оۼ��ķ������ܱ���ȼ�������Ʒ����������ϡ����������仯��ϵ����ͼ��ʾ(������Ƭ��Ʒֻ���������ʣ�������������)��

(1)����Ƭ������������������Ϊ_____��
(2)�����ϡ�����������������(д���������)��_____
(3)������ͼ�л������ɵ�����������ϡ����������仯��ϵͼ_____��
���𰸡�12.5% 19.6% 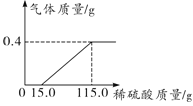
��������
��1����ͼ��֪������ǰ15g����ͺ���100g���ᵼ�µĹ��������һ�£�˵����һ���������������ᷴӦ�����ĵ�����Ϊ15g����ʱ��Ӧ�Ĺյ���11.2g������Ƭ������������������=![]() ���ڶ��������������Ӧ�����ĵ����������Ϊ100g����Ӧ����������Ϊ11.2g��
���ڶ��������������Ӧ�����ĵ����������Ϊ100g����Ӧ����������Ϊ11.2g��
��2�����ϡ�����������������Ϊx�����ɵ�����������Ϊy��
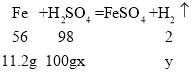
![]() x=19.6%��
x=19.6%��
![]() y=0.4g��
y=0.4g��
���ԴӼ���15gϡ����ʱ���������ɣ���115gϡ����ʱ��ȫ��Ӧ�����ɵ�����������Ϊ0.4g�����ɵ�����������ϡ����������仯��ϵͼ��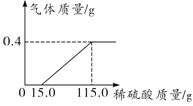 ��
��

 һŵ��ҵ�����ҵ���ּ�����������������ϵ�д�
һŵ��ҵ�����ҵ���ּ�����������������ϵ�д�����Ŀ�����¾�Ϊ���л�ѧ�������ʣ���H��C��N��O��S��Na��Ca��Fe��Ԫ���е�һ�ֻ�����ɣ���ѧС��������ͼʵ�飬��ش�
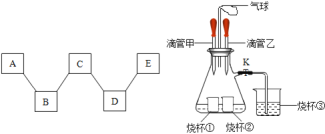
��1������ͬѧʵ���й۲쵽��Һ����ɫ��Ϊdz��ɫ��������Ӧ�ķ���ʽΪ_____��
��2������ͬѧͨ��ʵ�鷢����������֮��Ĺ�ϵ��ͼ��ʾ�������������˵�������һ�������¿��Է�Ӧ����A��E�ֱ����ڵ��ʡ�������ᡢ����е�����������к�ɫ���塢��ɫ���塢��ɫ��Һ���������ݵ������������C�Ļ�ѧʽΪ_____��D��E��Ӧ�Ļ�ѧ����ʽΪ_____��A��B��Ӧ�Ļ�ѧ����ʽΪ_____��
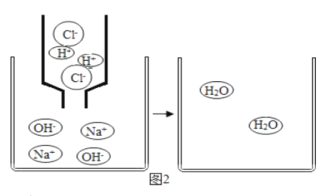
��3������ͬѧ��ͼ2����ʵ�飬�ȹرյ��ɼ�K�������е�Һ�強�����۲쵽�������Թ���һ��ʱ���ָ�ԭ״���ٽ����е�Һ�強�������ɼ�K���ձ�����Һ�嵹������ƿ�У�����ƿ�ײ���Һ�ɺ�ɫ��Ϊ��ɫ�����������������뽫�±��е��Լ�����������
�ιܼ� | �ձ��� | �ι��� | �ձ��� | ��ƿ����Һ | �ձ��� | |
�Լ� | H2O | _____ | _____ | _____ | _____ | _____ |