题目内容
【题目】现有某铝铁锌合金(A1﹣Fe-Zn)样品8.3g,将其放入200g稀硫酸中,经测定恰好完全反应,蒸发结晶,称量所得固体质量为27.5g,则所用稀硫酸的溶质质量分数为( )
A. 9.8% B. 6.26% C. 22.6% D. 19.6%
【答案】A
【解析】
A1、Fe、Zn三种金属都能与稀硫酸反应生成氢气,2Al+3H2SO4=Al2(SO4)3+3H2↑、 Fe+H2SO4=FeSO4+H2↑、Zn+H2SO4=ZnSO4+H2↑,反应后,蒸发结晶,固体增多的质量是硫酸中硫酸根的质量,则稀硫酸中硫酸的质量为:(27.5g-8.3g)÷9698![]() =19.6g,所用稀硫酸的溶质质量分数为:19.6g200g
=19.6g,所用稀硫酸的溶质质量分数为:19.6g200g![]() ×100%=9.8%,故选A。
×100%=9.8%,故选A。

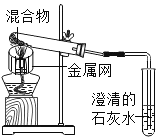
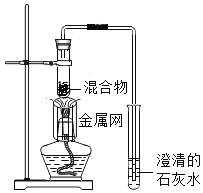
【题目】为探究碳还原氧化铜的最佳实验条件,用木炭粉和氧化铜的干燥混合物进行系列实验。
(査阅资料)碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:![]() 。
。
(进行实验)实验1:取质量比1:11的木炭粉和氧化铜混合物![]() ,进行实验。
,进行实验。
序号 | | |
装置 |
|
|
反应后物质的 颜色、状态 | 黑色粉末中混有少量红色固体 | 红色固体有金属光泽,混有极少量黑色物质 |
实验2:取一定量的混合物,用1-2装置进行实验。
序号 | 木炭粉与氧化铜的质量比 | 反应后物质的颜色、状态 | |
| 1:9 | 红色固体有金属光泽 | 混有少量黑色物质 |
| 1:10 | 混有很少量黑色物质 | |
| 1:11 | 混有极少量黑色物质 | |
| 1:12 | 无黑色物质 | |
| 1:13 | 混有较多黑色物质 | |
(1)实验![]() 中,证明产生了
中,证明产生了![]() 的现象是______。
的现象是______。
(2)实验![]() 比
比![]() 更好的原因是______。
更好的原因是______。
(3)实验2的结论是______。
(反思与评价)
(4)实验2没有进行质量比为1:14的实验,理由是______。
(5)为检验![]() 的红色固体中是否
的红色固体中是否![]() 请你设计实验方案三
请你设计实验方案三![]() 方法、现象及结论
方法、现象及结论![]()
方法:______。可能的现象及结论______。
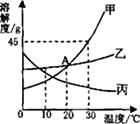
【题目】根据如表信息,相关说法正确的是( )
温度℃ | 溶解度/g | |||
NaCl | KCl | NH4Cl | KNO3 | |
20 | 36.0 | 34.0 | 37.2 | 31.6 |
40 | 36.6 | 40.0 | 45.8 | 63.9 |
60 | 37.3 | 45.5 | 55.2 | 110 |
A. 20℃时,NaCl的溶解度为36.0
B. 40℃时,KCl饱和溶液的溶质质量分数为40%
C. 60℃降温到20℃时,KNO3和KCl的饱和溶液析出晶体较多的是KNO3
D. 40℃时,向100g水中加入50gNH4Cl充分溶解,溶液质量为145.8g