题目内容
【题目】元素周期表是学习和研究化学的重要工具,它的内容十分丰富。下表是依据元素周期表画出的1—18号元素的原子结构示意图。我对它进行研究:
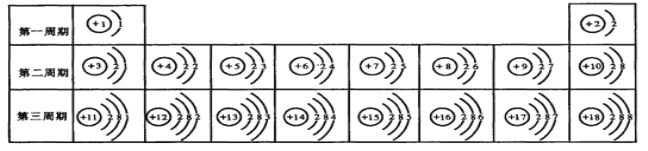
(1)原子序数为17的元素的原子容易__________(填“得”或“失”)电子;原子序数为13的元素属于 ___________元素(填“金属”或“非金属”)。
(2)表中不同种元素最本质的区别是_________(填番号)
A.质子数不同; B.中子数不同
C.相对原子质量不同; D.电子数不同
(3)元素周期表中每一横行叫一周期,每一竖行叫一族。某元素的原子结构示意
图![]() ,则该元素应排在第_______周期________族,它的化学性质和上表的________和________(填元素名称)的化学性质最相似 ,据你所学的知识推测该元素属于____________(金属或非金属)元素。
,则该元素应排在第_______周期________族,它的化学性质和上表的________和________(填元素名称)的化学性质最相似 ,据你所学的知识推测该元素属于____________(金属或非金属)元素。
(4)阅读下文,回答问题。
实验证明:在上表同一横行,从左到右,原子失去电子的能力逐渐减弱,得到电子的能力逐渐增强;在同一纵行中,从上到下,原子失去电子的能力逐渐增强,得到电子的能力逐渐减弱。上表中,失去电子能力最强的原子是___________(填原子符号,下同),得到电子能力最强的原子是____________.
【答案】⑴ 得 金属 ⑵ A
⑶ 5 ⅦA 氟元素 氯元素 非金属⑷Na F
【解析】
试题分析:⑴非金属元素:最外层电子数≥4,易得电子,原子序数为17的元素的原子最外层电子数为7,故容易得电子;原子序数为13的元素是铝元素,是“金字旁”,属于金属元素
⑵元素:具有相同质子数(或核电荷数)的一类原子的总称,因此:元素的种类由原子的质子数决定,质子数不同,元素种类不同;故选A
⑶在元素周期表中:周期数=电子层数,族数=最外层电子数,故则该元素应排在第5周期ⅦA族。元素的化学性质由原子的最外层电子数决定。当两种原子的最外层电子数相同,则这两种元素的化学性质相似。故它的化学性质和上表的氟元素和氯元素的化学性质最相似。根据最外层电子数=7>4,故推测该元素属于非金属元素
⑷根据同一横行,从左到右,原子失去电子的能力逐渐减弱,得到电子的能力逐渐增强;在同一纵行中,从上到下,原子失去电子的能力逐渐增强,得到电子的能力逐渐减弱。上表中,失去电子能力最强的原子是Na,得到电子能力最强的原子是F

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】学习了MnO2对过氧化氢分解有催化作用的知识后,某同学想:CuO能否起到类似MnO2的催化作用呢?于是进行了以下探究.
【猜想】
Ⅰ.CuO不是催化剂,也不参与反应,反应前后质量和化学性质不变;
Ⅱ.CuO参与反应产生O2,反应前后质量和化学性质发生了改变;
Ⅲ.CuO是反应的催化剂,反应前后 .
【实验】用天平称量0.2g CuO,取5mL 5%的过氧化氢溶液于试管中,进行如下实验:
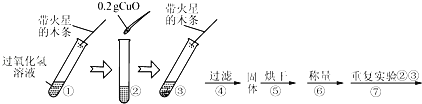
(1)填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
带火星的木条复燃 | 溶液中有气泡放出,带火星的木条复燃 | 猜想Ⅰ、Ⅱ不成立;猜想Ⅲ成立 |
(2)过氧化氢能被氧化铜催化分解放出氧气的文字表达式为 .
