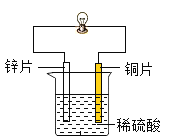
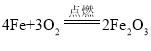题目内容
【题目】制备氯化钙。氯化钙是重要的化工原料。某工业碳酸钙所含的杂质主要是氧化铁及一些不与酸碱反应的难溶性物质,以这种工业碳酸钙为原料生产氯化钙的主要流程如图所示:

(1)流程中的X、Y分别是(写化学式)_________、___________。操作1、2分别是_________、___________.
(2)步骤②发生化学变化的方程式._____________。
(3)步骤④加入试剂x的目的是____________。
【答案】HCl Ca(OH)2 过滤 蒸发结晶 ![]() 除去过量的氢氧化钙
除去过量的氢氧化钙
【解析】
稀盐酸和碳酸钙反应生成氯化钙、水和二氧化碳,氧化铁和稀盐酸反应生成氯化铁和水,氯化铁和氢氧化钙反应生成氢氧化铁和氯化钙。
(1)工业碳酸钙所含的杂质主要是氧化铁及一些不与酸碱反应的难溶性物质,稀盐酸和碳酸钙反应生成氯化钙、水和二氧化碳,氧化铁和稀盐酸反应生成氯化铁和水,氯化铁和氢氧化钙反应生成氢氧化铁和氯化钙,故流程中的X、Y分别是HCl、Ca(OH)2。操作1是将固体和液体分离,2是将固体水分蒸发,得到晶体,故操作1、2分别是过滤、蒸发结晶。
(2)步骤②发生的反应是氯化铁和氢氧化钙反应生成氢氧化铁和氯化钙,故发生化学变化的方程式![]() 。
。
(3)稀盐酸和氢氧化钙反应生成氯化钙和水,氢氧化钙过量,故步骤④加入试剂x的目的是反应掉过量的氢氧化钙。

 阅读快车系列答案
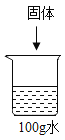
阅读快车系列答案【题目】已知20℃时,NaCl和NaNO3的溶解度分别为36g和88g,依据下列20℃时的实验和数据判断,下列说法不正确的是
| 序号 | ① | ② | ③ | ④ | ⑤. |
固体种类 | NaCl | NaCl | NaNO3 | NaNO3 | NaNO3 | |
固体的质量/g | 30 | 60 | 30 | 60 | 90 | |
水的质量/g | 100 | 100 | 100 | 100 | 100 |
A.②⑤属于饱和溶液:
B.溶液质量:②<④
C.溶质质量分数:①=③
D.⑤中溶质与溶剂的质量比为9:10