题目内容
【题目】化学反应在防治环境污染中扮溃宅要角色。某厂废气中的SO,可用以下方案处理。
方案一:2SO2+O2+2CaO![]() 2CaSO4
2CaSO4
方案二:2SO2+O2+4NaOH=2Na2SO4+2H2O
(已知:CaSO4的价格为700元/吨)试计算:
(1)Na2SO4中有两种元素的质量分数呈整数倍关系,这两种元素是__________(用元素符号表示)。
(2)若采用方案一处理SO29.6t,所得产品的价值是多少元?(请根据化学方程式进行计算,写出计算过程。)__________
【答案】S、O 14280
【解析】
(1)根据硫酸钠的化学式求算元素智力比,进而确定对应的元素;
(2)根据方案一和对应的二氧化硫的质量以及化学方程式求算生成的硫酸钙的质量,进而确定产品的价值。
解:(1)Na2SO4中钠元素、硫元素和氧元素的质量比(23×2):32:(16×4)=23:16:32,所以两种元素的质量分数呈整数倍关系为硫元素和氧元素,对应的元素符号为S和O;
(2)设生成的硫酸钙的质量为x,

![]()
x=20.4t,价值为20.4t×700元/吨=14280元;
答:(1)Na2SO4中有两种元素的质量分数呈整数倍关系,这两种元素是 S和O;
(2)若采用方案一处理SO29.6t,所得产品的价值是14280元。

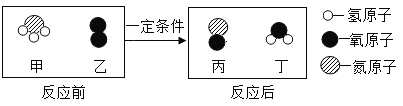
【题目】学习了金属的性质后,同学们设计了以下实验验证铁铜银的金属活动性顺序
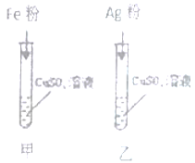
(1)能证明铁铜银活动性顺序的现象是________。
(2)甲试管内的化学反应方程式为________。
(3)实验结束后,将甲乙试管内的剩余物质都倒在一起,充分反应过滤,得到滤渣和滤液。
探究一、A组同学对滤渣的成分进行探究,向滤渣中加入稀盐酸,观察到无气泡产生,滤渣的成分为_______。
探究二、B组同学对滤液成分进行探究,提出猜想
猜想一:溶质只有FeSO4猜想二:_________
设计实验
实验步骤 | 实验现象 | 结论 |
取一定量滤液于试管中,____ | ________ | 猜想二正确 |
【题目】为研究锌和铝的金属活动性 ,某研究小组进行了如下探究。
(1)小明设计方案:向表面积相同的铝片和锌粒中分别加入盐酸,根据反应的快慢判断两者的活动性强弱。写出铝与盐酸反应的化学方程式:________。
(2)小芳将一砂纸打磨过的铝片放入一定量的盐酸中,发现有气泡产生 ,还观察到有“灰黑色沉淀”这一异常现象出现。
(提出问题)铝与盐酸反应出现的灰黑色沉淀的组成是什么?
(查阅文献)①铝在颗粒较小时为灰黑色,AlCl3为无色透明晶体或白色而微带浅黄色的固体,易溶于水和乙醇。②一种金属加入到两种活动性均比它弱的金属化合物溶液的混合液中,会先置出最弱的金属。再置换出第二种金属。该金属会先和最弱的金属盐溶液反应。
(提出合理假设)假设a:该灰黑色沉淀可能含有_________;假设b:该灰黑色沉淀可能含有AlCl3;假设c:该灰黑色沉淀可能含有难溶于酸的物质。
(设计并完成实验)取灰黑色沉淀分别进行如下实验。
实验编号 | 实验操作 | 实验现象 |
① | 加入适量稀盐酸 | 有微量气泡,固体全部溶解,得到澄清溶液 |
② | 加入适量蒸馏水 | 固体部分溶解 |
③ | 加入适量无水乙醇 | 固体部分溶解 |
(得出结论)由实验①可判断假设c_____________(填“成立”或“不成立”,)再集合②和③可得出该灰黑色沉淀的成分是__________。
(3)你认为①中小明的实验能否比较锌和铝的金属活动性强弱?______(填“能”或“不能”),分别从设计方法或操作可行性的角度,具体说明理由(一点即可)_____。
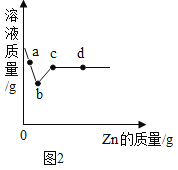
(拓展延伸)附加分:若正确回答下列小题,将获得4分的奖励 ,但化学试卷总分不超过60分。为继续研究另一种金属锌的化学性质,小敏向一定质量的硝酸银和硝酸铜的混合溶液中加入锌粉,溶液质量与加入锌的质量关系如图所示。那么,在a点时,溶液里含的金属化合物有_________种;bc段发生的化学反应方程式为_________;d点得到的固体的成分为_____