题目内容
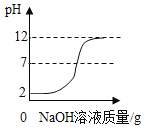
【题目】为探究氢氧化钙溶液和稀盐酸反应所得溶液中溶质的成分,小鸣和同学们通过测定了反应后溶液的pH,得到了如图所示的pH曲线,请回答:
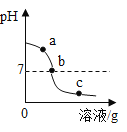
(1)由图可知该实验操作是将______滴加到另一种溶液中;
(2)该反应的化学方程式为______;
(3)实验过程中,小鸣取了a、b、c三处反应后的溶液于三个烧杯中,却忘了作标记,请你设计不同的方案![]() 不再用测定pH的方法
不再用测定pH的方法![]() ,探究三种样品分别属于哪处溶液。
,探究三种样品分别属于哪处溶液。
(查阅资料)![]() 溶液显中性
溶液显中性
(探究过程)![]() 分别取少量样品于三支试管中,加入酚酞溶液,观察到其中一支试管内出现______的现象。结论:该样品是a处溶液。
分别取少量样品于三支试管中,加入酚酞溶液,观察到其中一支试管内出现______的现象。结论:该样品是a处溶液。
![]() 为进一步确定b或c处溶液,又设计了以下方案:
为进一步确定b或c处溶液,又设计了以下方案:
实验步骤 | 实验现象 | 实验结论 |
另取余下样品少量于两支试管中,分别滴加足量的 | 该样品为b处溶液 | |
______ | 该样品为c处溶液 |
(分析与思考)
(1)c处溶液呈酸性,则溶液中使其呈酸性的离子是______![]() 填离子符号
填离子符号![]() ,此时溶液中含有的溶质为______。
,此时溶液中含有的溶质为______。
(2)在加入![]() 溶液后,b处溶液发生的化学反应方程式为______。
溶液后,b处溶液发生的化学反应方程式为______。
(反思评价)探究反应后溶液中溶质的成分,除了要考虑生成物之外,还要考虑______。
【答案】稀盐酸 Ca(OH)2+2HCl═CaCl2+2H2O 溶液变红色 先产生气泡,后产生白色沉淀 H+ 氯化钙、氯化氢 Na2CO3+CaCl2═CaCO3↓+2NaCl 反应物是否过量
【解析】
(1)由图可知,溶液pH由大于7逐渐减小,说明该实验操作是将稀盐酸滴加到氢氧化钙溶液中;
(2)盐酸和氢氧化钙反应生成氯化钙和水,反应的化学方程式为:Ca(OH)2+2HCl═CaCl2+2H2O;
(3)①分别取少量样品于三支试管中,加入酚酞溶液,观察到其中一支试管内溶液变红色,说明溶液显碱性,a处溶液pH大于7,显碱性,因此该样品是a处溶液;
②另取余下样品少量于两支试管中,分别滴加足量的Na2CO3溶液,先产生气泡,后产生白色沉淀,是因为碳酸钠先和盐酸反应生成氯化钠、水和二氧化碳,后和氯化钙反应生成碳酸钙沉淀和氯化钠,说明溶液中含有盐酸和氯化钙,c处溶液盐酸过量,含有盐酸和氯化钙;[分析与思考](1)c处溶液呈酸性,则溶液中使其呈酸性的离子是H+,此时溶液中含有的溶质为氯化钙、氯化氢;
(2)在加入Na2CO3溶液后,b处溶液中含有氯化钙,氯化钙反应生成碳酸钙沉淀和氯化钠,反应化学反应方程式为:Na2CO3+CaCl2═CaCO3↓+2NaCl;
[反思评价]探究反应后溶液中溶质的成分,除了要考虑生成物之外,还要考虑反应物是否过量。

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案【题目】某兴趣小组同学利用下图所示装置进行“铝与硫酸铜溶液反应”的实验时,发现反应开始后试管中出现红色固体同时产生无色无味气体。兴趣小组同学进行了以下探究。

实验1:向5份相同体积的硫酸铜溶液中分别加入表面经过打磨处理的相同长度的铝条,现象如下:
实验组别 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
硫酸铜溶液浓度 | 24% | 12% | 8% | 6% | 5% | 3% | 1% |
气泡情况 | 很快 | 快 | 较快 | 快 | 较快 | 慢 | 无 |
实验2:向质量分数为8%的硫酸铜溶液分别加入表面经过打磨处理的相同长度的铝条,现象如下:
实验组别 | ① | ② | ③ | ④ | ⑤ |
水浴温度(℃) | 20 | 30 | 40 | 50 | 60 |
气泡情况 | 较快 | 快 | 很快 | 很快 | 很快 |
(1)实验1的目的是______。
(2)实验2的结论是______。
(3)依据实验1和实验2,推测50℃ 5% 硫酸铜溶液与铝条反应的现象是________。
(反思与评价)
(4)实验2没有进行温度为70℃的实验,理由是_______。
(5)根据你的猜想,气泡中的气体是______。