��Ŀ����
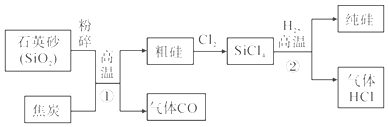
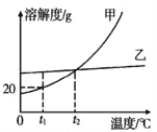
����Ŀ���ҹ��Ƽҵ��������°��Ƽ����ư���������������Ƽ��Ϊ����͵��ʹ�ҵ�����ķ�չ�����˽ܳ��Ĺ��ס���������������ʾ��ͼ��ͼ��
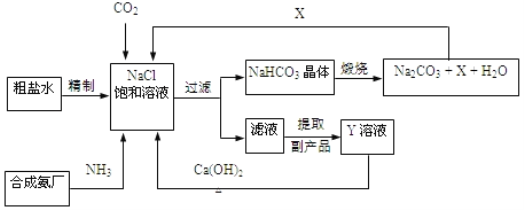
�Ƽ�ԭ������Ҫ��һ����Ӧ��ʾΪ��NaCl+CO2+NH3+H2O��NaHCO3��+NH4Cl
��1������ˮ���ƹ��������ȥ�Ȼ����к��еĿ���������MgCl2��CaCl2��Na2SO4�����������³��Ӳ��� �����������Na2CO3��Һ�� �����������BaCl2��Һ�������������NaOH��Һ��������������ϡ��������ˡ�����ʱ��ȷ�IJ���˳��Ϊ����_____��������ţ�������Na2CO3��Һ��������_____��
��2��X�Ļ�ѧʽΪ_____��
��3��Y����Һ������Ҫ�ɷ֣�Y��Ca��OH��2��Ӧ�IJ���֮һ������ѭ��ʹ�ã�Y�Ļ�ѧʽΪ_____���˷�Ӧ�����Ŀ�ѭ�����õ����ʵ�����Ϊ_____��
��4����ľ�ҿ����طʣ�����һũ�����������Ҷɫ���ơ�����ϸС��ʩ��ʱ_____��������������������������ͬʱʩ��Y�Ͳ�ľ�ҡ�
���𰸡��������������� ��ȥCaCl2������BaCl2 CO2NH4Cl ���� ������
��������
����ȥ����ɳ�Ȳ��������ʵĴ�������ˮ��õ�����Һ�к���MgCl2��CaCl2��Na2SO4����������Һ�м���������NaOH��Һ����ʱ�õ��Ļ����Ϊ��Mg��OH��2������Na2SO4��CaCl2��NaOH��NaCl������յõ��Ļ���м��������BaCl2��Һ����ʱ�õ��Ļ����Ϊ��Mg��OH��2������BaSO4������CaCl2��NaOH��NaCl��BaCl2�����������м��������Na2CO3��Һ���õ��Ļ����Ϊ��Mg��OH��2������BaSO4������CaCO3������NaOH��BaCO3������NaCl��Na2CO3���˻���ᆳ���˺�õ�NaOH��Na2CO3��NaCl�Ļ����Һ����ʱ�������������ᣬ���ɵõ��ϴ������Ȼ�����Һ�������ȡ�Ȼ��Ƽ��ɡ�
��1��ע���һ���ڢٵ�ǰ�棬��Ϊ̼���Ƽȿ��Գ�ȥ�Ȼ����ֿ��Գ�ȥ�������Ȼ�������һ���ڢݵĺ��棬��������IJ��ֳ����ֻ��ܽ�����µ����ʣ�
��2��̼���������ȷֽ�Ϊ̼���ơ�ˮ��������̼��X�Ƕ�����̼��������̼�Ļ�ѧʽΪCO2��
��3��Y���Ȼ�泥�����Һ������Ҫ�ɷ֣��仯ѧʽΪNH4Cl����Ca��OH��2��Ӧ�IJ���֮һ������ѭ��ʹ�ã��ò��������Ϊ������
��4����ľ�ҳʼ��ԣ��̬������������ʷ�Ӧ���ͷŰ��������ͷ�Ч������̼鱗������ľ�һ��ʹ�á�

 ����С����ͬ������ϵ�д�
����С����ͬ������ϵ�д�