题目内容
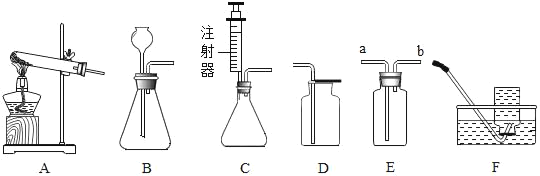
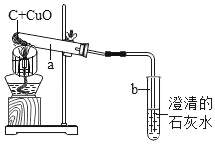
【题目】某研究性小组在实验室用如图实验装置做木炭还原氧化铜的实验,实验中观察到试管a内发生的现象是_____,试管b内澄清石灰水变浑浊,证明有_____生成.
实验在高温条件下充分反应.兴趣小组对实验后试管a内的固体成分发生了兴趣,激发了探究热情.
(提出问题):“反应后试管a内的固体物质是什么?
(进行猜想):小静同学认为该固体全部是铜;
小华同学认为该固体是铜与氧化铜两种物质的混合物;
小东同学认为该固体是铜与_____两种物质的混合物;
小明同学认为该固体可能是铜、木炭和氧化铜三种物质的混合物
小华认为因为是充分反应,所以_____同学的猜想明显不成立
(查阅资料)稀硫酸是无色液体:
木炭、铜都不与稀硫酸反应,氧化铜能与稀硫酸反应得到蓝色硫酸铜溶液
(实验设计)
实验操作 | 实验现象 | 实验结论 |
取少量固体物质于试管中,加足量稀硫酸充分震荡 | 黑色固体溶解,溶液变成蓝色 | 固体中有_____ |
(反思评价):_____同学的评价是正确的;
(定量探究):现取炭碳与氧化铜的混合物18g,高温条件下充分反应,剩余固体的质量为13.6g,经测定其中氧化铜有剩余,请通过计算确定原混合物中碳和氧化铜各有多少克_____?
【答案】黑色固体变红色 二氧化碳(或CO2) 木炭 小明 氧化铜 小华 原混合物中碳和氧化铜各有1.2g和16.8g.
【解析】
在高温条件下,木炭将黑色氧化铜还原成铜,同时生成了二氧化碳。铜是红色的,所以,实验的现象是:出现红色固体。试管a内发生的化学反应方程式为:2CuO+C![]() 2Cu+CO2↑;试管b内澄清石灰水变浑浊,证明有二氧化碳生成。
2Cu+CO2↑;试管b内澄清石灰水变浑浊,证明有二氧化碳生成。
[进行猜想]:由于木炭和氧化铜的量不确定,所以,试管a内的固体物质可能是:全部是铜或铜与氧化铜两种物质的混合物或铜与木炭两种物质的混合物。由于反应是充分反应,氧化铜和木炭中只剩下一种,所以,小明的猜想明显不成立;
[实验探究]:由于氧化铜能够与硫酸反应生成硫酸铜,溶液显蓝色;碳能与氧化铜反应生成二氧化碳,二氧化碳能使澄清的石灰水变浑浊;所以实验方案是:
实验操作 | 实验现象 | 实验结论 |
取少量固体物质于试管中,加足量稀硫酸充分震荡 | 黑色固体溶解,溶液变成蓝色 | 固体中有氧化铜 |
通过上述实验可知,剩余固体中含有铜和氧化铜,小华同学的猜想是正确的;
[定量探究]:充分反应生成二氧化碳的质量=18g﹣13.6g=4.4g。
设反应掉的碳的质量为x
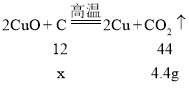
![]()
x=1.2g
原混合物中氧化铜的质量=18g﹣1.2g=16.8g。
答:原混合物中碳和氧化铜各有1.2g和16.8g。