题目内容
【题目】兴趣小组获得两包制作“跳跳糖”的添加剂,一包是柠檬酸晶体,另一包是标注为钠盐的白色粉末。将少量柠檬酸和这种白色粉末溶于水,混合后产生了使澄清石灰水变浑浊的气体。于是对白色粉末的化学成分进行了以下探究:
(提出猜想)猜想1:碳酸钠;猜想2:碳酸氢钠;猜想3:碳酸钠和碳酸氢钠。
(查阅资料)①碳酸钠溶液、碳酸氢钠溶液均呈碱性;②碳酸氢钠受热分解生成碳酸钠、水和二氧化碳;碳酸钠受热不分解。
(实验探究)小月、小妮分别对有关猜想设计方案并进行实验:
实验操作 | 实验现象 | 实验结论 | |
小月 | 将白色粉末溶于水后,常温下用pH试纸测定其酸碱度 | pH____7(填“>”“<”或“=”) | 溶液呈碱性,猜想1成立 |
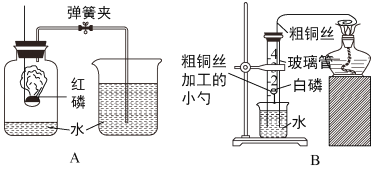
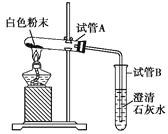
小妮 | 用下图所示的装置进行实验 | 试管A中有水珠产生,试管B中液体变浑浊 | 猜想2成立,试管B中反应的化学方程式为_________。 |
(交流反思)大家一致认为小月和小妮的结论不准确:
(1)小月实验结论不准确的原因是_____________;
(2)小妮的实验方案不能排除白色粉末是否含有_________。
(继续探究)小威称取m g白色粉末与足量稀盐酸反应,充分反应后生成二氧化碳的质量为n g,通过计算并分析实验数据确定猜想3正确,则n的取值范围为______(用含m的代数式表示)。
(结论分析)探究后他们核查到添加剂的成分是柠檬酸和碳酸氢钠,分析后认为白色粉末中的碳酸钠是由碳酸氢钠分解产生的。
(拓展应用)下列物质常温下放置一段时间质量不会发生改变的是____(填序号)。
A浓硫酸 B氢氧化钠 C氧化钙 D氯化钠
【答案】> CO2+Ca(OH)2=CaCO3↓+H2O 碳酸钠溶液、碳酸氢钠溶液均呈碱性 碳酸钠 ![]() <n<
<n<![]() C
C
【解析】
[实验探究]小月:由于碳酸钠溶液呈碱性。所以溶液的pH>7;
小妮:由于二氧化碳能使澄清的石灰水变浑浊,常用澄清的石灰水检验二氧化碳,反应的化学方程式是:CO2+Ca(OH)2=CaCO3↓+H2O;
[交流反思](1)由于碳酸钠溶液、碳酸氢钠溶液均呈碱性,溶液的pH>7,所以小月实验结论不准确;
(2)由于碳酸钠和碳酸氢钠的混合物受热也会生成了水和二氧化碳,所以不能排除白色粉末中混有碳酸钠;
[继续探究]
若碳酸钠的质量为m,设与盐酸反应生成的二氧化碳的质量为x

若碳酸氢钠的质量为m,设与盐酸反应生成的二氧化碳的质量为y
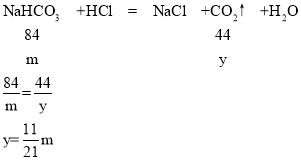
猜想3正确,即白色粉末是碳酸钠和碳酸氢钠的混合物,则n的取值范围为:![]() <n<
<n<![]() ;
;
[拓展应用]浓硫酸、氢氧化钠、氯化钠在常温下放置一段时间不会发生变化,碳酸氢铵不稳定,常温下放置一段时间会发生分解。
故答为:[实验探究]>;小妮:CO2+Ca(OH)2=CaCO3↓+H2O;
[交流反思](1)碳酸钠溶液、碳酸氢钠溶液均呈碱性;(2)碳酸钠;
[继续探究]![]() <n<
<n<![]() ;
;
[拓展应用]C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案