题目内容
(9分)火力发电厂用石灰石泥浆吸收废气中的二氧化硫以防止污染环境,其反应方程式为:
2CaCO3(粉末)+2SO2+O2==2CaSO4+2CO2。
(1)若100克废气中含6.4克二氧化硫,则处理100克这种废气需含碳酸钙(CaCO3)80%的
石灰石多少克。
(2)处理上述100克废气,可得到含CaSO485%的粗产品多少克。
设需含CaCO380%的石灰石的质量为x,则含纯物质CaCO3的质量为80%×x.又设生成纯CaSO4质量为y.
2CaCO3+2SO2+O2═2CaSO4+2CO2
200 128 272
80%×x 6.4g y
6.4g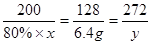 解得:x=12.5g y=13.6g
解得:x=12.5g y=13.6g
可得到含CaSO485%的粗产品的质量是: =16g
=16g
答:(1)需含碳酸钙(CaCO3)80%的石灰石12.5克.
(2)处理上述100克废气,可得到含CaSO485%的粗产品16克.
解析试题分析:首先要明确在利用化学方程式进行计算用料和产量时,由于化学方程式表示的是纯净物质之间的质量关系,利用公式:纯度= ×100%%,找到已知量和未知量.最后根据化学方程式计算的步骤、格式,结合着不纯物质和纯物质之间的相互转化方法,列出比例式求解即可.
×100%%,找到已知量和未知量.最后根据化学方程式计算的步骤、格式,结合着不纯物质和纯物质之间的相互转化方法,列出比例式求解即可.
考点:根据化学反应方程式的计算

练习册系列答案
相关题目

 2CO2+3H2O,现有100g质量分数为92%的乙醇溶液在空气中完全燃烧产生二氧化碳的质量为多少克?
2CO2+3H2O,现有100g质量分数为92%的乙醇溶液在空气中完全燃烧产生二氧化碳的质量为多少克?  CaO+CO2↑
CaO+CO2↑