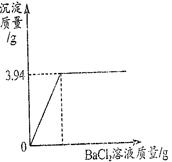
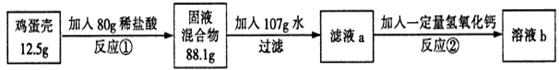
题目内容
工业上用煅烧石灰石制备二氧化碳。现有含杂质10%的石灰石100 t(杂质不参与反应,且不含钙元素),经高温煅烧后,若测得剩余固体中钙元素的质量分数为50%。
已知:CaCO3 CaO+CO2↑
CaO+CO2↑
通过计算回答:
(1)生成二氧化碳的质量。
(2)石灰石中的碳酸钙是否完全分解。
(1)28t (2)未完全分解
解析试题分析:已知:石灰石的质量为100t,杂质含量为10% 剩余固体中,钙元素的质量分数为50% 未知:二氧化碳的质量、参加反应的碳酸钙的质量
解题思路:钙元素的质量在化学反应中是不变的。1、可先求出原石灰石中钙元素的质量;2、利用钙元素的质量求出剩余固体的质量;3、利用反应前后固体质量的变化求出生成二氧化碳气体的质量;4、利用反应的化学方程式求出参加反应的碳酸钙的质量;5、判断碳酸钙是否完全反应。
解:石灰石中碳酸钙的质量:100t×(1-10%)=90t
石灰石中钙元素的质量:90t×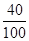 ×100%=36t
×100%=36t
剩余固体的质量: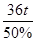 =72t
=72t
生成二氧化碳的质量:100t-72t=28t
设消耗碳酸钙的质量为x。
CaCO3 CaO+CO2↑
CaO+CO2↑
100 44
x 28t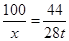
x≈63.6t
因为63.6t<90t,所以石灰石中碳酸钙未完全分解。
答:生成二氧化碳的质量为28t,石灰石中碳酸钙未完全分解。
考点:根据化学式的计算、根据化学方程式的计算

练习册系列答案
相关题目
小强对当地的石灰石矿石样品进行检测,取用100g这种石灰石样品,把300g稀盐酸分3次加入,实验过程所得数据见下表(已知石灰石样品中含的杂质不溶于水,不与盐酸反应)。请计算:
(1)下表中m的数值应该为 。
(2)样品中碳酸钙的物质的量是 mol。
| 序号 | 加入稀盐酸质量(g) | 剩余固体质量(g) |
| 第1次 | 100 | 60 |
| 第2次 | 100 | m |
| 第3次 | 100 | 12 |
(3)参加反应的盐酸的质量分数 (根据化学方程式列式计算)。(精确0.1%)
 Ti + 2MgCl2。现有380kg四氯化钛,理论上可生产纯度为95%的金属钛多少千克?(计算结果保留一位小数)
Ti + 2MgCl2。现有380kg四氯化钛,理论上可生产纯度为95%的金属钛多少千克?(计算结果保留一位小数)