题目内容
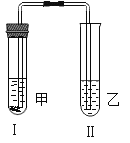
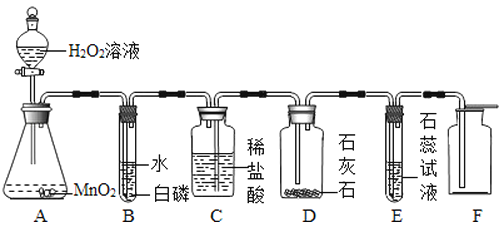
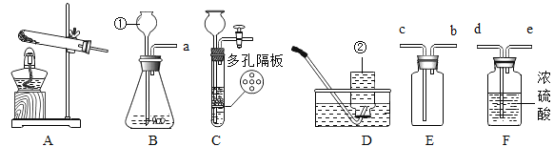
【题目】已知某固体样品A可能是Na2CO3、MgCl2、Mg三种物质中的一种或多种, 另有一固体样品B,其中可能含有NH4Cl、CuO、Fe(NO3)3三种物质中的一种或多种,为了确定其成分,按下图所示进行实验探究,产生的现象如图所示(假设过程中发生的反应均为恰好完全进行)。

请根据实验过程和发生的现象,回答下列问题:
(1)气体F通入无色酚酞试液中,试液变________色。
(2)若沉淀G为混合物,则沉淀G为________。
(3)溶液I中含有的金属阳离子是________(填写离子符号)。
(4)写出过程④中产生沉淀H 的一个化学反应方程式________。
(5)固体A中不能确定的物质是______(填写化学式),得出此结论的理由是______。
【答案】红 Fe(OH)3、CuO Mg2+、Na+ ![]() ,【或
,【或![]() 】。 MgCl2 步骤③中石灰水未变浑浊,说明气体不是二氧化碳而是氢气,则原混合物中一定含有镁而无碳酸钠,镁与盐酸反应会生成氯化镁,所以无法判断固体样品A中是否含有氯化镁
】。 MgCl2 步骤③中石灰水未变浑浊,说明气体不是二氧化碳而是氢气,则原混合物中一定含有镁而无碳酸钠,镁与盐酸反应会生成氯化镁,所以无法判断固体样品A中是否含有氯化镁
【解析】
氯化铵和氢氧化钠反应生成氯化钠、水和氨气,硝酸铁和氢氧化钠反应生成氢氧化铁和硝酸钠,镁和稀盐酸反应生成氯化镁和氢气,氯化钠和硝酸银反应生成氯化银和硝酸钠,氯化镁和和硝酸银反应生成硝酸镁和氯化银,碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳。
(1)氯化铵和氢氧化钠反应生成氯化钠、水和氨气,气体F为氨气,氨气溶于水,形成氨水,显碱性,故气体F通入无色酚酞试液中,试液变红色。
(2)氧化铜和氢氧化钠不反应,硝酸铁和氢氧化钠反应生成氢氧化铁和硝酸钠,若沉淀G为混合物,则沉淀G为Fe(OH)3、CuO。
(3)镁和稀盐酸反应生成氯化镁和氢气,溶液中含有氯化镁和氯化钠,氯化铵和氢氧化钠反应生成氯化钠、水和氨气,硝酸铁和氢氧化钠反应生成氢氧化铁和硝酸钠,氯化钠和氯化镁均与硝酸银反应生成氯化银沉淀,故溶液I中含有的金属阳离子是钠离子和镁离子,离子符号为Mg2+、Na+。
(4)过程④中产生沉淀H 的反应是氯化钠和硝酸银反应生成氯化银和硝酸钠,氯化镁和和硝酸银反应生成硝酸镁和氯化银,反应的化学方程式为![]() ,【或
,【或![]() 】。
】。
(5)碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,气体通入澄清石灰水,无明显现象,说明不含碳酸钠,含有镁,故固体A中不能确定的物质是氯化镁,化学式为MgCl2,得出此结论的理由是步骤③中石灰水未变浑浊,说明气体不是二氧化碳而是氢气,则原混合物中一定含有镁而无碳酸钠,镁与盐酸反应会生成氯化镁,所以无法判断固体样品A中是否含有氯化镁。

【题目】把A、B、C、D四种物质放在密闭容器中,在一定条件下充分反应,并测得反应物和产物在反应前后各物质的质量如表所示:
物质 | A | B | C | D |
反应前质量 |
|
|
|
|
反应后质量 | 待测 |
| 0 |
|
下列说法正确的是![]()
A. 物质C一定是反应物,物质D可能是单质
B. 反应后密闭容器中A的质量为![]()
C. 反应过程中,物质B和物质D变化的质量比为87:36
D. 若物质A与物质C的相对分子质量之比为194:216,则反应中A和C的化学计量数之比为2:1