题目内容
【题目】某同学利用“多米诺骨牌”效应,设计了如图气体制取与性质验证的组合实验,打开A中分液漏斗的活塞,很快看到E中导管口有气泡冒出,且溶液由紫色变红色。
请看图回答问题:
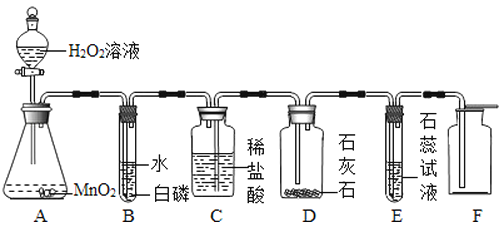
① A中反应的化学方程式____________,A装置的主要优点是_________;
B中白磷不燃烧,原因是_____________。
② C、D中看到的现象分别是____________。
③ 用化学方程式表示E中颜色变化的原因___________________________。
④ F中的现象是__________,体现了该气体性质是_________________。
【答案】2H2O2![]() 2H2O + O2↑能得到平稳的氧气流(合理即可)温度没有达到着火点C中液面下降,液体流入D中,D中产生大量气泡(全对2分,对1~2点得1分)CO2 + H2O → H2CO3低的蜡烛先熄灭,高的蜡烛后熄灭密度比空气大,不可燃不助燃
2H2O + O2↑能得到平稳的氧气流(合理即可)温度没有达到着火点C中液面下降,液体流入D中,D中产生大量气泡(全对2分,对1~2点得1分)CO2 + H2O → H2CO3低的蜡烛先熄灭,高的蜡烛后熄灭密度比空气大,不可燃不助燃
【解析】(1)过氧化氢在二氧化锰的催化作用下生成水和氧气:2H2O2![]() 2H2O + O2↑;过氧化氢接触到二氧化锰后,反应便立即开始,不能人为控制其速率和生成氧气的量,故要控制其反应速率,可通过控制过氧化氢的加入量来实现;分液漏斗就可以控制加入液体药品的量和速率,得到平稳的氧气流;燃烧需要同时满足三个条件:一是要有可燃物,二是可燃物要与氧气接触,三是温度要达到可燃物的着火点;以上三个条件都能满足时,可燃物才能发生燃烧。而B中的白磷只具备的氧气的条件,温度没有达到着火点,故不能燃烧;(2)A中发生反应后,产生的氧气通过B进入到C中,导致C中的压强变大,稀盐酸进入D中使石灰石和稀盐酸反应生成大量的气泡,故现象是:C中液面下降,液体流入D中,D中产生大量气泡;(3)二氧化碳与水反应生成碳酸,碳酸能使紫色的石蕊试液变成红色:CO2 + H2O → H2CO3;(4)二氧化碳先聚集在烧杯的底部,与下面的蜡烛先接触,故现象是低的蜡烛先熄灭,高的蜡烛后熄灭。该现象说明二氧化碳的密度比空气大,既不能燃烧也不能组成燃烧。
2H2O + O2↑;过氧化氢接触到二氧化锰后,反应便立即开始,不能人为控制其速率和生成氧气的量,故要控制其反应速率,可通过控制过氧化氢的加入量来实现;分液漏斗就可以控制加入液体药品的量和速率,得到平稳的氧气流;燃烧需要同时满足三个条件:一是要有可燃物,二是可燃物要与氧气接触,三是温度要达到可燃物的着火点;以上三个条件都能满足时,可燃物才能发生燃烧。而B中的白磷只具备的氧气的条件,温度没有达到着火点,故不能燃烧;(2)A中发生反应后,产生的氧气通过B进入到C中,导致C中的压强变大,稀盐酸进入D中使石灰石和稀盐酸反应生成大量的气泡,故现象是:C中液面下降,液体流入D中,D中产生大量气泡;(3)二氧化碳与水反应生成碳酸,碳酸能使紫色的石蕊试液变成红色:CO2 + H2O → H2CO3;(4)二氧化碳先聚集在烧杯的底部,与下面的蜡烛先接触,故现象是低的蜡烛先熄灭,高的蜡烛后熄灭。该现象说明二氧化碳的密度比空气大,既不能燃烧也不能组成燃烧。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案