题目内容
(2012?宜昌)元素周期表是化学学习的重要工具,依据下表回答问题:
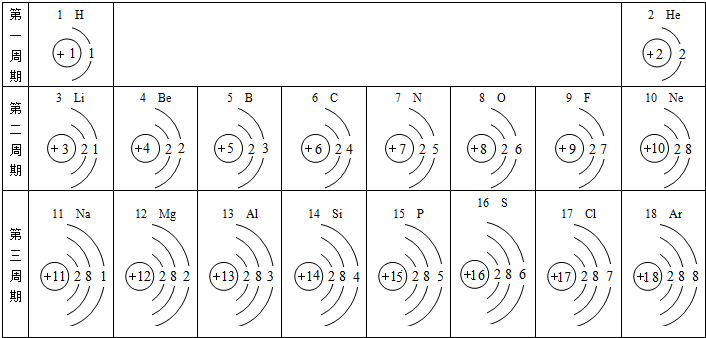
(1)表中9号元素属于
(2)氮化镁的化学式为
(3)F、Cl、S三种非金属元素的原子得电子能力逐渐减弱,我能根据这三种非金属元素的原子结构推测:非金属元素的原子得电子能力的强弱主要与

(1)表中9号元素属于
非金属
非金属
(填“金属”或“非金属”)元素,在化学反应中易得到
得到
(填“失去”或“得到”)电子,形成F-
F-
(填离子符号).(2)氮化镁的化学式为
Mg3N2
Mg3N2
.(3)F、Cl、S三种非金属元素的原子得电子能力逐渐减弱,我能根据这三种非金属元素的原子结构推测:非金属元素的原子得电子能力的强弱主要与
最外层电子数
最外层电子数
、电子层数
电子层数
有关.分析:(1)根据元素周期表中每一小方格的信息解答,原子序数等于质子数,质子数决定元素种类
(2)根据最外层电子数推出元素的化合价进行解答;
(3)根据原子结构示意图分析解答.
(2)根据最外层电子数推出元素的化合价进行解答;
(3)根据原子结构示意图分析解答.
解答:解:(1)9号是原子序数,也是质子数,为氟元素,属于非金属元素,最外层有7个电子易得到电子,成为阴离子,离子符号为:F-,故填:非金属;得到;F-;
(2)镁最外层电子数为2,易失去形成+2价的镁元素,由F-知,氮元素的化合价为-3价,所以形成的化学式为:Mg3N2,故填:Mg3N2;
(3)氟原子有2个电子层,最外层有7个电子,氯原子和硫原子都有3个电子层,而氯原子最外层电子为7,硫原子最外层电子数为6,三种非金属元素的原子得电子能力逐渐减弱,与最外层电子数或电子层数有关.故填:最外层电子数、电子层数;
(2)镁最外层电子数为2,易失去形成+2价的镁元素,由F-知,氮元素的化合价为-3价,所以形成的化学式为:Mg3N2,故填:Mg3N2;
(3)氟原子有2个电子层,最外层有7个电子,氯原子和硫原子都有3个电子层,而氯原子最外层电子为7,硫原子最外层电子数为6,三种非金属元素的原子得电子能力逐渐减弱,与最外层电子数或电子层数有关.故填:最外层电子数、电子层数;
点评:明确元素周期表的排列原则及特点,了解原子结构示意图是解答本题关健.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案
相关题目